肠道碱性磷酸酶解毒脂多糖并预防炎症在肠道微生物群的响应
来源:
|
作者:詹妮弗·M·贝茨1,Janie Akerlund,Erika Mittge,和Karen Guillemin
|
发布时间: 2020-06-23
|
13053 次浏览
|
分享到:
脊椎动物的肠道菌群中含有丰富的脂多糖(LPS)或内毒素。我们证明,刷状缘酶-肠碱性磷酸酶(Iap)在斑马鱼肠道菌群形成过程中被诱导从而在促进黏膜对肠道细菌的耐受中起着关键作用。我们证明,iap缺乏的动物对lps的毒性反应是通过Myd88和肿瘤坏死因子受体(Tnfr)介导的机制来感应的。我们进一步证明,内源性微生物群通过一个涉及myd88和tnfr的过程建立了肠道中性粒细胞的正常稳态水平。iap缺乏的动物表现出过多的肠道中性粒细胞流入,类似暴露于lps的野生型动物。但在无细菌饲养的情况下,缺乏Iap的动物的肠道内缺乏中性粒细胞,这表明iap具有防止肠道细菌炎症反应的功能。
1神经科学研究所,俄勒冈大学,尤金,OR 97403,美国
2俄勒冈大学分子生物学研究所,尤金, OR 97403,美国
纲要
脊椎动物的肠道菌群中含有丰富的脂多糖(LPS)或内毒素。我们证明,刷状缘酶-肠碱性磷酸酶(Iap)在斑马鱼肠道菌群形成过程中被诱导从而在促进黏膜对肠道细菌的耐受中起着关键作用。我们证明,iap缺乏的动物对lps的毒性反应是通过Myd88和肿瘤坏死因子受体(Tnfr)介导的机制来感应的。我们进一步证明,内源性微生物群通过一个涉及myd88和tnfr的过程建立了肠道中性粒细胞的正常稳态水平。iap缺乏的动物表现出过多的肠道中性粒细胞流入,类似暴露于lps的野生型动物。但在无细菌饲养的情况下,缺乏Iap的动物的肠道内缺乏中性粒细胞,这表明iap具有防止肠道细菌炎症反应的功能。
介绍
lps是所有革兰氏阴性细菌(包括病原体和共生菌)外膜的主要成分,作为一种细菌相关物质被单独发现,称为内毒素,可引起动物感染性休克(Beutler and Rietschel, 2003) 。我们现在知道lps通过过度刺激toll样受体(toll-like receptor,tlr)固有免疫信号发挥毒素作用,从而诱导致病性炎症反应。缺乏内毒素特异性TLR4或TLRs下游常见适配器MYD88的小鼠对内毒素毒性的抵抗力增强(Kawai et al., 1999; Poltorak et al.,1998) 。TLR信号通过myd88促进nf-κb的核移位和肿瘤坏死因子(tnf)等促炎细胞因子的转录。TNF是脓毒性休克的重要介质,在用TNF阻断抗体治疗的小鼠中观察到的内毒素抵抗证明了这一点(Beutler et al., 1985)。TNF也并不是LPS毒性的唯一介质,事实表明,缺乏TNFα的小鼠(Pasparakis等人,1996年)、其主要受体TNFRP55(Pfeffer等人,1993年)或其75和55 kD受体(Rothe等人,1993年)与野生型小鼠一样,对高剂量的LPS腹腔注射敏感。h它们对低剂量的脂多糖和肝细胞毒素dgalactosamine有更强的抵抗力。TNF和其他促炎性细胞因子诱导血管通透性,血流和中性粒细胞募集进入LPS来源,以及全身反应,例如发烧,在感染性休克的极端情况下,弥散性血管内凝血,低血压甚至最终导致器官功能障碍。
脊椎动物体内lps最丰富的来源之一是肠道菌群。自从发现识别病原体和宿主有益微生物分子特征的先天免疫信号途径以来,一个尚未解决的问题就是为什么肠道微生物群落不会在宿主体内引发病理性炎症。事实上,对微生物群的不当炎症反应在炎症性肠病患者中表现出来(Sartor,2006)。在健康个体中,提倡的保护机制包括从肠上皮分离iga涂层的肠道微生物(macpherson等人,2005年)、肠上皮的屏障功能和肠上皮细胞中固有免疫受体的限制性表达(cario和podolsky,2005年)。
除了通过隔离促炎配体及其受体来限制先天免疫信号外,宿主细胞还可以通过改变促炎微生物分子本身来主动调节炎症反应。这种机制已在一种酰基氧基水解酶的情况下被证明,该酶从脂类lps的一部分裂解酰基链(feulner等人,2004)。在缺乏这种酶的小鼠中,酰化脂多糖在感染革兰氏阴性病原体后持续较长时间,并导致B细胞增殖和抗体产生增加(Lu等人,2005)。碱性磷酸酶(AP)也被证明通过使脂类A部分去磷酸化来修饰脂多糖(Beumer等人,2003;Koyama等人,2002;Tuin等人,2006;Van Veen等人,2005)。脂类A是脂多糖的毒性成分,它含有两个与葡萄糖胺结合的磷酸基团;除去其中一个磷酸基团可生成一个磷酰脂类A,其毒性比未经修饰的脂类A低100倍(Schromm等人,1998)。
在脊椎动物中,aps广泛分布于不同的器官,但其生理基础在很大程度上未知。缺乏普遍表达的组织非特异性AP(TNAP)的小鼠因磷酸吡哆醛代谢缺陷而死于癫痫发作(Waymire等人,1995),论称维生素B-6是小鼠TNAP的天然底物。肠道特异性同工酶(iap)一直是肠上皮细胞成熟的标志物,但其在肠内的生理功能尚不清楚。蛋白质定位于顶端刷缘,富含表面活性剂样颗粒,分泌到肠腔(Alpers等人,1995)。这种酶的活性急剧增加发生在哺乳动物和鱼类胚胎后发育期间,即肠道微生物群建立的时期(Bates等人,2006年;Henning,1985年;Zambonino Infante和Cahu,2001年)。IAP被认为在酪蛋白的消化和吸收中起作用(Li Chan和Nakai,1989)。然而,缺乏iap的小鼠没有明显的消化缺陷,并且实际上表现出脂肪滴通过肠壁的加速运输,当喂食高脂肪饮食时会导致肥胖(nakano等人,2007;narisawa等人,2003)。
我们假设Iap作用于与肠道细菌相关的去磷酸脂多糖,从而调节肠道炎症反应,以应对常驻微生物群。我们用斑马鱼模型测试了这个想法,因为可以比较容易的使用无菌生物学操作和控制细菌关联,利用吗啉反义寡核苷酸(mos)来操纵宿主基因表达。硬骨鱼类和哺乳动物消化道的发育和生理学非常相似(Wallace等人,2005年),两者都对其常驻微生物群有保守的反应(Cheesman和Guillemin,2007年)。我们实验显示斑马鱼像哺乳动物一样,通过涉及Myd88和Tnfr的机制对LPS做出反应。我们报道定居后,肠道微生物通过与外源性LPS相似的机制引起低水平的肠道炎症。最后,我们证明了Iap功能对于解脂LPS和防止肠道炎症反应是必需的。
斑马鱼肠道内碱性磷酸酶基因的鉴定
在先前的工作中,我们显示了在受精后(dpf)5至8天之间,该器官被微生物定殖的期间斑马鱼肠中的刷状缘AP活性增加,但在饲养GF的动物中却没有增加(Bates等,2006)。我们发现,通过用常规饲养(CV)对照中的菌群接种5 dpf GF斑马鱼,我们可以将正常Iap水平恢复8 dpf。此外,我们证明lps暴露足以诱导GF动物中Iap的活性。为了研究LPS调节Iap的机制和功能意义,我们试图鉴定斑马鱼的Iap基因。人类的AP由四个基因座编码:1号染色体上的TNAP和组织特异性同功酶IAP,胎盘AP和生殖细胞AP,它们聚集在染色体2q37的位置,似乎是由串联重复产生的(Millán,2006)。为了分离斑马鱼中的iap基因,我们将编码IAP的鼠Akp3序列(登录号:M61705.1)与斑马鱼基因组进行了比较,该基因组产生了两个碱性磷酸酶基因,分别位于11和22号染色体。与人类相似,这些ap基因是高度相关,但其表达方式而有所不同(Le Du和Millan,2002)。与注释为碱性磷酸酶(alp)的11号染色体ap转录本(登录号:NM_201007)的原位杂交在5 dpf处表现出低水平的普遍表达(数据未显示)。 相比之下,与鼠Akp3共享75%序列同一性的无注释染色体22 ap基因(登录号:NM_001014353)在5 dpf幼虫的肠上皮中特异性表达(图1A,B)。 对来自8 dpf幼虫的解剖肠进行RT-PCR分析,显示了肠22号ap基因的特异性表达,而11号ap染色体的转录在肠中以及在被我们去除肠的样本中的含量都很低(图 1C)。
接下来,我们通过用特定于该基因的剪接阻断MO来阻断该基因的表达来测试该基因是否编码了斑马鱼肠中的AP活性(图S1A)。当饲养到8 dpf时,与野生型(WT)肠相比,注射iap-MO的动物的肠表现出显着降低的AP活性(图1D)。 Iap-MO特异地抑制了肠道中AP的活性,并且没有改变缺乏肠道的cas体中的AP活性(图1D)。我们观察到从5 dpf浸入10mM L-苯丙氨酸(L-phen)(一种IAP同工酶的特异性抑制剂)的溶液中,对8 dpf的鱼具有类似的肠道特异性抑制活性(Fishman等,1963)(图1D)。用抗α,3半乳糖基转移酶(galT)基因的对照MO处理不会改变Iap活性(图1E)。根据这些结果,我们将22号染色体ap基因指定为斑马鱼肠道碱性磷酸酶(iap)。来自注射iap-MO的动物的肠道保留了一些AP活性,这可能是由于在这些动物中存在一些WT iap转录物表明,在8 dpf时iap-MO的抑制作用不完全(图S1A)。此外,由于iap-MO对5 dpf肠的总AP活性没有抑制作用,但对8 dpf肠的AP活性却降低了,因此肠道中的某些AP活性很可能是由无处不在的alp基因编码的(图S1B ),尽管在更早的时间点可以更有效地阻止IAP转录剪接(数据未显示)。
细菌脂多糖对斑马鱼Iap转录的调节
我们以前曾报道过,纯化的LPS浓度为3μg/ ml,足以在GF幼虫中诱导Iap活性达到CV对照水平(Bates等,2006)。在这里,我们测试了Iap活性是否可以被其他LPS进一步诱导。我们观察到,暴露于30μg/ ml LPS的CV幼虫的Iap活性显着高于未处理水平(图1E)。如我们先前所示,GF幼虫与来自斑马鱼肠的革兰氏阴性细菌分离株(气单胞菌和假单胞菌属)单缔合足以诱导Iap活性达到CV水平,但是当我们将GF幼虫与数个革兰氏单亲结合时阳性分离株(链球菌和葡萄球菌)在其细胞壁上缺乏LPS,我们没有观察到Iap活性的诱导(图1E和数据未显示)。这些结果表明,LPS足以在斑马鱼中诱导Iap活性。
为了了解Iap诱导的机制,我们检查了CV和GF幼虫中Iap转录本的程度。半定量RT-PCR显 示,暴露于50μg/ ml LPS 24h后,肠道中的iap转录水平增加,而在整个处理过程中,整个生 物体中alp的转录均保持不变(图1C)。使用定量逆转录PCR(qRT-PCR),我们发现,类 似于Iap酶活性的调节,在细菌存在下,iap转录水平显着提高(图1F)。此外,暴露于外源LPS(30μg/ ml,持续24小时)足以增加GF幼虫的Iap转录水平,并使Iap高于CV幼虫的 正常水平(图1F)。
细菌对Iap活性的调节依赖于Myd88
响应LPS的Iap的诱导表示该基因受Tlr信号传导调控的可能性。在斑马鱼基因组中已经鉴定出几种Tlr4直向同源物和一个编码Myd88的单一基因(Jault等,2004; Meijer等,2004)。为了测试Myd88对于LPS诱导Iap是否重要,我们使用了剪接阻断MO来斑马鱼myd88(图S1C)。注入myd88-MO的鱼没有表现出明显的形态缺陷(数据未显示),与斑马鱼用不同的myd88-MO(van der Sar等,2006)和Myd88-/-小鼠(Iiyama等, 2003)。为了测试Myd88是否需要Iap活性的幼虫上调,我们从myd88-MO注射的幼虫中解剖了肠,并分析了组织的AP活性。尽管在5 dpf时CV或GF WT动物之间,myd88-MO注射动物肠道的AP活性是无法区分的,但在肠道细菌定殖开始时,myd88-MO注射幼虫的肠道AP活性却没有增加8 dpf,与GF WT动物相似(图1E),表明CV动物中Iap的微生物群依赖性诱导是Myd88依赖性的。接下来,我们调查了Myap88依赖方式是否通过外源LPS调节了Iap转录本的程度。使用qRT-PCR,我们发现用myd88-MO注射的幼虫用50μg/ ml纯化的LPS处理24小时无法增加IAP(图1F),表明Myd88是LPS介导的IAP诱导所必需的。
脂多糖对斑马鱼的致毒
摄入或腹腔注射高剂量的脂多糖对哺乳动物是有毒的(van Amersfoort等人,2003)。脊椎动物对脂多糖毒性表现出广泛的敏感性:与大鼠和小鼠相比,小牛非常敏感,而鱼和青蛙更具抵抗力(Berczi等人,1966年)。我们发现,将6 dpf斑马鱼幼虫浸泡在含有高浓度LPS的水中会导致死率、存活率和杀灭动力学与LPS剂量成正比。5dpf的幼虫对lps的杀灭更有抵抗力,这可能是由于tlr信号通路基因的表达减少,在某些情况下,tlr信号通路基因的表达具有动态的发育表达谱(jault等人,2004)。在6dpf时,30μg/ml lps剂量不能致死,50μg/ml剂量在48小时能达到 100%死亡率,150μg/ml剂量在4.5小时达到 100%死亡率,250μg/ml剂量导致2小时内100%幼虫死亡(图2a)。与哺乳动物相似,暴露于脂多糖的斑马鱼也表现出器官衰竭,表现为心跳和嗜睡减少,以及水肿和血池,这可能是严重心动过缓的结果(数据未显示)。
Lps毒性在哺乳动物中具有典型的组织病理学特征,包括肝脏、心脏和肠道的损伤,以及受感染的水肿和中性粒细胞浸润。对斑马鱼幼鱼暴露于100μg/ml脂多糖24小时并在死亡前处死的肝脏进行组织学分析,发现肝细胞肿胀、紊乱(图2c)和髓过氧化物酶(MPO)阳性中性粒细胞浸润(图2f),与脂多糖致敏小鼠的病理报告相似(Inoue等人,2005)。与lps中毒的哺乳动物一样,我们还观察到mpo阳性中性粒细胞在lps处理的幼虫体内的肠道浸润,如下所述。
LPS毒性在哺乳动物中的一个特征是诱导高水平的促炎性细胞因子Tnf转录。用50μg/ ml LPS处理的7 dpf幼虫的qRT-PCR分析显示了两种斑马鱼tnf直向同源物的显着瞬时诱导,在暴露后4h诱导达到较高水平,到8h后显着下降(图2D)。在LPS诱导的大鼠菌血症模型(Xuan等,2001)和斑马鱼胚胎中,革兰氏阴性鱼病原菌爱德华氏菌感染的菌血症模型中观察到了类似的瞬时Tnf诱导(Pressley等,2005)。
LPS毒性在哺乳动物中的另一个特征是TLR和TNF信号的参与。我们发现,注入myd88-MO的幼虫在LPS暴露后表达的tnf转录物水平较低(图2D)。此外,在两种不同的LPS浓度下,myd88-MO注射的幼虫对LPS杀灭的抵抗力明显更高(图2G,Logrank测试,P <0.0001)。为了测试Tnfr在对LPS响应中的可能作用,我们使用了对斑马鱼tnfr1进行剪接阻断的MO(图S1D)。在两种不同的LPS浓度下,注射tnfr1-MO的鱼类对LPS的抵抗力也比野生型鱼类明显更高(图2H,Logrank测试,P <0.0001)。注射myd88-和tnfr1-MO的幼虫均服从LPS治疗,尽管动力学较慢,这可能分别是由于Myd88和Tnfr对LPS毒性的独立机制以及MOs不完全抑制所致(图S1C,D)。
Iap可防止LPS毒性
我们假设内源性iap的作用是解毒肠上皮细胞遇到的lps。首先,我们通过将7只dpf幼虫暴露于250μg/ml lps(已用纯化的小牛肠道碱性磷酸酶(ciap)预处理)中,来测试去磷酸化lps是否与哺乳动物细胞一样具有较少的促炎性和较少的毒性(koyama等人,2002)。去磷酸化脂多糖未能诱导TNF或IAP的表达(图2D,数据未显示),对斑马鱼完全无毒,而相同剂量的模拟处理脂多糖在2小时内造成100%的致死率(图3A)。
接下来,我们测试了Iap活性降低的斑马鱼对LPS的敏感性是否增加。通过将5个DPF幼虫浸泡在10毫米L-phen溶液中或注射IAP-mo抑制IAP,可显著提高对LPS的敏感性(图3B、C)。给6只dpf-wt幼虫注射30μg/ml lps,48小时内死亡率不高,而用10mml l-phen在4dpf下预处理,然后用lps在6dpf下暴露,48小时内死亡率为100%(图3b,logrank检验,p<0.0001)。单用左旋苯处理的对照幼虫在同一时期未显示出致死性(图3B)。在7dpf条件下,当暴露于150μg/ml lps时,经l-phen处理的幼虫也明显比wt幼虫更敏感(图3b,logrank,p<0.0001)。同样,注射iapmo的幼虫对lps处理更为敏感,在7dpf时给予150μg/ml剂量,死亡率约为90%,而对照动物的存活时间更长(图3c,logrank检验,p<0.0001)。最后,我们观察到降低iap活性的gf动物(见图1e)对150μg/ml lps的敏感性也增加(图3c,logrank检验,p<0.0001)。这些数据共同表明,内源性Iap可以针对生物学上相关范围的外源性LPS浓度提供保护。
微生物群调节肠道中性粒细胞的稳态数量
我们接下来验证Iap是否在调节肠道对lps的炎症反应中起作用。我们发现在gf和cv 8-dpf幼虫之间,肿瘤坏死因子转录的水平没有变化,但这不足为奇,因为这些基因响应促炎性刺激(图2D)或菌血症激发而表达的瞬时特性(Pressley等, 2005年)。我们描述了肠道内中性粒细胞稳态对微生物群定植的响应。MPO被用作斑马鱼粒细胞或中性粒细胞的标记物,这些粒细胞或中性粒细胞已被证明渗透到与哺乳动物中性粒细胞相似的伤口部位(Bennett等人,2001;Lieschke等人,2001;Mathias等人,2006;Renshaw等人,2006)。与gf斑马鱼6dpf幼虫相比,cv的肠道中mpo转录水平升高(rawls等人,2004)。我们计数了幼虫肠道远端140μm的mpo阳性中性粒细胞,观察到这些细胞的优势分布。我们发现,在该器官的微生物定殖过程中,肠道中Mpo阳性中性粒细胞的平均数量增加,远端肠中平均2个中性粒细胞为6 dpf CV幼虫,到8 dpf时平均增加到平均7个中性粒细胞(图4Q ,R)。相比之下,GF肠在6和8 dpf时完全没有Mpo阳性中性粒细胞,表明中性粒细胞被吸收到肠道以响应微生物群(图4Q,R)。
我们接下来研究了肠道中性粒细胞募集的机制。我们发现,150μg/ml lps暴露2小时后,mpo阳性的肠中性粒细胞显著增加(6 dpf中17个,8 dpf-cv幼虫中22个,图4d,e,q,r)。相比之下,暴露于150μg/ml经ciap处理的lps中2小时未能引起8只dpf幼虫中性粒细胞的任何增加(图4r)。根据我们的结果显示,myd88和tnfr1在其它lps反应中的重要性,我们测试了myd88 mo或tnfr1-mo是否能抑制肠道中性粒细胞的募集,我们发现myd88mo注射的幼虫在饲养cv时没有mpo阳性的肠道中性粒细胞,并且显著减少了lps的数量。这些细胞暴露于脂多糖(图4k,m,r)。同样,当饲养cv和暴露于lps时,注射tnfr1-mo的幼虫肠道上皮中缺乏mpo阳性中性粒细胞(图4l,n,r)。我们的研究结果表明,tlr和tnf信号在中性粒细胞流入肠道的过程中,对促炎性刺激以及由常驻微生物群建立的肠道中性粒细胞的稳态水平都起着作用。
Iap可防止对常驻微生物群的炎症反应
接下来,我们检查了Iap在调节对微生物群的肠道炎症反应中的作用。在这些实验中,我们要么用iap-MO抑制6 dpf的Iap(当剪接阻断更有效时,数据未显示),要么用L-phen抑制8 dpf。我们发现,以6 dpf的剂量通过iap-MO注射的幼虫或以8 dpf的剂量进行L-phen处理的幼虫中Mpo阳性肠中性粒细胞的数量显着大于野生型对照,并且与暴露于LPS的幼虫中的数量相似(图4C ,F,O,Q,R)。接下来,我们测试了中性粒细胞的流入是否由与暴露于LPS或微生物群的野生动物相同的基于Myd88和Tnfr1的机制介导。在双倍注射了iap-和myd88-MOs(图4G,Q)或iap-和tnfr1-MOs(图4H,Q)的幼虫中,肠道Mpo阳性中性粒细胞数量大大减少(图4Q) Iap在Myd88和Tnfr1的上游起作用。最后,为了证明iap功能是必需的上游促炎化合物与常驻微生物群,我们检查了在没有微生物的情况下饲养的iap缺陷幼虫的中性粒细胞数量。当在生长因子条件下饲养时,iap-mo注射的6只dpf幼虫和l-phen处理的8只dpf幼虫的肠上皮中mpo阳性中性粒细胞数量非常低(图4h,p,q,r)。野生型gf肠道能够募集中性粒细胞,这一点可以从这些动物对lps暴露的强烈中性粒细胞流入中得到证明(图4r)。这些结果表明,gf-iap缺乏的幼虫缺乏肠道中性粒细胞,因为它们缺乏iap的促炎症基质,这与内源性iap对肠道细菌相关lps的解毒作用是一致的。
探讨
利用GF斑马鱼模型,我们发现LPS在肠道细菌定植期间诱导Iap活性(bates等人,2006)。哺乳动物Iap是肠上皮细胞分化的标志物,但其内源性底物尚不清楚。Iap能够使许多不同的LPS血清型脱磷(tuin等人,2006),这是一种产生无毒分子形式的反应。我们测试了一种假设,即斑马鱼的Iap可以解毒与肠道细菌相关的LPS。
已知lps及其信号传导的下游产物对哺乳动物有毒性,但此前这种反应还未在斑马鱼中被发现过。我们报道了LPS治疗斑马鱼导致剂量依赖性死亡、器官衰竭、肝细胞肿胀和中性粒细胞浸润等特征性组织病理学改变以及炎性细胞因子、tnfa和tnfb的动态转录诱导。斑马鱼和小鼠间的LPS致死剂量是很难比较的,因为我们使用了水源给药途径,这会导致LPS摄入以及皮肤和鳃的暴露。在8dpf斑马鱼幼体肠道内,我们估计大约有4×105个细菌,其中大部分为革兰氏阴性,在大约1至4nl的体积内,导致大约1011/ml的细菌浓度,类似于人类结肠的细菌浓度(savage,1977)。根据沙门氏菌的总内毒素和脱落内毒素的测量(Freudenberg等人,1991年),该细菌密度将斑马鱼肠道中总内毒素的浓度定为mg/ml,脱落内毒素的浓度定为几十μg/ml,在本研究使用的浓度范围内。在败血性休克的小鼠模型中,LPS通常以约50 mg / kg体重的剂量腹膜内给药以达到100%的致死率,并且口服时毒性降低约10倍(Youngner,1972)。我们表明,在斑马鱼中,与在哺乳动物中一样,通过抑制Myd88和Tnfr可以改善LPS的毒性。此外,用纯化的CIAP预处理LPS使其对斑马鱼完全无毒。最后,我们证明了通过药理作用或基因特异性MO抑制内源性Iap会导致对LPS毒性超敏反应。
为了测试这种酶在预防炎症反应中对微生物群的作用,我们研究了中性粒细胞进入肠道的调节。我们发现肠道上皮中Mpo阳性中性粒细胞的稳态数量是由微生物群建立的,而GF幼虫缺乏所有这些细胞。我们没有发现 巨噬细胞参与肠道微生物或外源性脂多糖的炎症反应的证据。从GF、CV和LPS暴露的鱼的解剖内脏中分离的RNA显示出Mpo水平与肠道中性粒细胞数量相关的显著差异,而我们观察到这些样本之间巨噬细胞特异性基因、集落刺激因子1受体的转录水平没有差异(未发表的结果)。我们证明,在微生物群定植时建立肠道免疫细胞内稳态使用相同的蛋白质,myd88和tnfr1,它们促进肠道炎症对外源性lps的反应。这些结果表明先天免疫信号在黏膜免疫成熟中的重要性,类似于在myd88缺陷小鼠的肠道相关淋巴组织中观察到的细微发育缺陷(iiyama等人,2003)。在小鼠中,已证明myd88功能仅在髓细胞而不是肠上皮细胞中被要求用于对肠损伤的微生物依赖性反应(Pull等人,2005)。确定斑马鱼肠中myd88功能的细胞分布和需求将是一个有趣的课题。
微生物群通过与内毒素类似的机制引发肠道炎症的能力,突出了宿主策略的重要性,即选择合适的微生物群落(在某些炎症性肠病中可能会出错的过程(Eckburg和Relman,2007))和限制该群落的炎症影响。事实上,抑制先天性免疫反应(如myd88介导的免疫反应)可能改变肠道微生物群落,从而间接导致肠道炎症的减少。然而,当我们将注射MYD88MO的微生物群和在同一水中一起饲养的对照幼虫培养时,我们观察到两组之间的细菌负荷或菌落形态没有显著差异(未公布的结果),这与微生物群的变化是导致MPO阳性中性粒细胞在小鼠体内缺失的原因相矛盾。
通过描述在有无微生物条件下Iap缺陷饲养鱼的中性粒细胞浸润,我们发现Iap作用于与微生物群相关的促炎信号上游。总之,我们的结果表明,在定植过程中被微生物群上调的Iap具有解毒微生物群相关lps的功能,从而建立一个稳态负反馈回路,防止tlr和tnf信号过量和肠道炎症(图5)。因此,Iap在限制常驻肠道微生物的促炎症潜能和促进粘膜对占斑马鱼微生物群很大比例的革兰氏阴性菌的耐受性方面发挥着重要作用(bates等人,2006;rawls等人,2006)。
重要的是,iap酶活性高度局限于顶部肠上皮(bates等人,2006),因此其lps解毒活性预计不会影响宿主对穿透肠上皮屏障的革兰氏阴性病原体的检测。除了刷状边界定位外,哺乳动物的iap也被证明是由肠细胞分泌的(alpers等人,1995),这增加了这种酶可能具有肠外活性的可能性,正如研究表明,在大鼠静脉注射纯化的小牛iap,然后注射lps后,肝细胞减少。与单纯注射脂多糖的对照大鼠相比的损伤(Tuin等人,2006年)。正如免疫系统在不同组织中的精细化一样,微生物产品的局部修饰可能代表微生物-宿主相互作用的一个未被充分认识的方面。宿主脂多糖毒性酰氧基水解酶(AOAH)在肾皮质的局部表达和分泌到尿液中可能有助于保护尿路免受革兰氏阴性菌的过度炎症反应(Munford,2005)。值得注意的是,在鱼类基因组中没有发现aoah同系物(munford和varley,2006),这表明其他lps解毒机制,如涉及aps的机制,可能在这些物种中发挥更重要的作用。在肺上皮细胞中表达的另一种宿主酶,哺乳动物乳糖酶,对氧磷酶-2(pon2),已被证明可降解细菌群体感应高丝氨酸内酯自诱导物,并干扰铜绿假单胞菌气管感染所需的信号机制(stoltz等人,2007)。在这里,我们已经证明Iap是另一种大量的宿主酶,用于修饰特定组织遇到的细菌信号。目前正在进行实验,以验证Iap在防止哺乳动物对微生物群的炎症反应方面的功能是否是保守的。
人类对脂多糖表现出广泛的反应。这种表型多样性的可能机制包括人类群体中TLR4基因的广泛多态性,对脂多糖反应较弱的TLR4等位基因与更高的肠道细菌感染发病率相关,但与慢性炎症相关的疾病风险降低(Miller等人,2005)。在哺乳动物AP基因中也存在相当程度的遗传多样性(MARAMAN),AKP2等位基因变体,编码TNAP,已被证明在小鼠中调节血清AP活性(Furman等),提示IAP基因的变化有助于LPS应答的可能性。iap活性的发育变异也可能对人类健康产生重要影响。例如,由于缺乏IAP活性,患坏死性小肠结肠炎的婴儿的早产儿可能会出现严重的炎症反应。
细菌-动物共生的特点是合作伙伴之间仔细协商,以优化其共享环境。互惠信号存在于这些相互作用中,微生物信号调节宿主过程,然后直接或间接影响微生物群的组成或活动。微生物肠道菌群已经被证明可以通过抑制k途径中的多个步骤来主动抑制炎症(Ismail和Hooper,2005),这里我们展示了斑马鱼中许多肠道菌群共有的一个信号,lps,上调iap,其功能是防止过度的肠道炎症,这一反应将有害于微生物群和宿主相似。
实验步骤
无菌斑马鱼养殖
所有实验的斑马鱼均遵循俄勒冈大学动物护理机构和使用委员会批准的实验方案并符合标准实验方案(Westerfield,1993)。如前所述(Bates等,2006),产生了CV,GF和与单缔合的幼虫,并评估了GF胚胎的无菌性。为了得到注射GF Iap-MO的动物,按照标准程序(Westerfield,1993),通过体外受精产生了胚胎,除了使用先前所述的抗生素胚胎培养基(Bates等,2006)使卵受精,然后如下所述注射iap-MO。然后按照先前的描述(Bates et al。,2006)将注射的胚胎衍生为GF,不同的是将0.003%的次氯酸钠浸泡的时间从30分钟减少到20分钟,另外将胚胎浸泡在0.1%的聚乙烯基吡咯烷酮碘2分钟。用于单分子生物学的细菌是斑马鱼分离株veronii veronii biovar sobria,荧光假单胞菌(Bates等,2006),链球菌和葡萄球菌菌株(未发表数据)以及从小鼠分离出的链球菌,它们定居在斑马鱼上(Rawls等,2006 )。通过将细菌培养物注射到GF 5 dpf幼虫的烧瓶中以达到106个菌落形成单位(CFU)/ ml的最终浓度来产生单关联动物,该细菌在8 dpf幼虫中的最终细菌载量与8 dpf CV幼虫相当((Bates等,2006)和未发表的数据)。
脂多糖和L-苯丙氨酸治疗
除非另有说明,通常情况下将经过LPS过滤器灭菌的溶液在7dpf(大肠杆菌血清型0111:B4,Fluka)注入GF和CV幼虫的最终浓度为3–250μg/ ml的烧瓶中。值得注意的是,从sigma购买的LPS产生了不同程度的结果,而从fluka购买的4个不同批次的lps给出了可重复的结果。商业来源的脂多糖含有微量的肽聚糖(pgn)和脂蛋白污染物(Hirschfeld等人,2000年)。为了测试lps是否是由pgn污染引起的,我们将7条dpf斑马鱼幼鱼暴露于高达1 mg/ml的纯化pgn(金黄色葡萄球菌77140,fluka)溶液中,但在24小时内没有观察到杀灭作用。为了测试lps毒性是否由脂蛋白污染物引起,我们将7条dpf斑马鱼暴露于合成脂肽pamcys ser-(lys),(alx-165-066,axxora)的溶液中,这种合成脂肽是已知的免疫佐剂(erhard等人,2000),高达500μg/ml,并且在24小时内也没有观察到这些处理的杀灭作用。为了产生去磷酸化的脂多糖,将脂多糖与从牛肠粘膜(alpi12g,biozyme实验室)纯化的0.148u/μl ciap在37℃孵育4h,然后在80℃孵育10min以破坏ciap活性。模拟处理过的lps是在相同条件下孵育而不添加ciap的lps。为了抑制iap,除非另有说明,否则在试验期间,幼虫在10 mm l-phen溶液中孵育,从5 dpf开始。在l-phen处理的仔鱼中观察到一些残余iap活性,但是较高剂量的化合物不易溶解,似乎对鱼有毒。
碱性磷酸酶-AP活性如前所述被量化(Bates等人,2006)。简单地说,从10个幼虫或从中取出肠子的尸体上分离出的肠子被汇集、称重、均质并在对硝基苯基磷酸酯液体基质系统(sigma)中培养30分钟,在405nm处测量吸光度。
吗啉注射液
剪接阻断吗啉(mos)是从基因工具(corvalis,or)中获得的,除了myd88e2i2,这是lalita ramakrishnan博士(华盛顿大学)慷慨的礼物。所有的MOs 在一个细胞期以指定的最终量注入胚胎:IAPe2i2 (3 pmoles), TRlv1/TRlv2 (1.2 pmoles and 6 pmoles, respectively), MyD88e2i2 (25 pmoles), galTe2i2 (5.9 pmoles). MO oligo sequences are as follows: IAPe2i2: 5′-TGTAAAGTCGTCTTCATCACTCACC-3′, MyD88 e2i2: 5′- GTTAAACACTGACCCTGTGGATCAT-3′,TRlv1:5′- TACGTCCTTGTGCATTGCTGGCATC-3′,TRlv2:5′- CTGCATTGTGACTTACTTATCGCAC-3′.galTe2i2:5′ AAATCATTATGCACTCACCTGATGG-3′.
通过RT-PCR分析来自注入的幼虫的cDNA,使用设计成跨剪接位点的特异性引物观察到剪接阻断。 引物序列如下:IAPe1F: 5′-TCAGAGGCTCGGGATGTGTTTG-3′, IAPe5R:5′-GACTTTCCTTGTGCTTTGGCG-3′;MyD88elF:5′- TCTTGACGGACTGGGAAACTCG-3′,MyD88e5R:5′- GATTTGTAGACGACAGGGATTAGCC-3′;TR1F:5′- GCATGGATCCATATCAGGACTTGGTGGA-3′,TR1R:5′。 myd88-MO显示接近完全的剪接阻断,而tnfr1-MO和iap-MO在8 dpf时部分阻断了目标转录物的剪接(图S1)TCGAGAATTCTTACGAAACGCTTGTGTT-3′.
半定量RT-PCR分析
收集20只对照动物或用150μg/ ml LPS处理2小时的20只动物的解剖肠或剩余动物尸体,并通过匀浆并用Trizol试剂(Invitrogen)提取来收集RNA。 使用不含Turbo DNA的试剂盒(Ambion)进一步纯化RNA,以污染基因组DNA。 按照制造商的说明,将RNA用作模板,用Superscript III逆转录酶和随机引物(Invitrogen)生成cDNA。 随后通过PCR进行cDNA扩增25个循环,每个循环包括在94°变性15s,在59°退火30s引物和在72°延伸1分钟。 使用Taq DNA聚合酶(Roche)和20 pmol基因特异性引物对200ng cDNA进行测定。引物序列如下:IAPF: 5′-ATGGGAGTGTCCACGGTTTCAG-3′IAPR:5′-CGATGCCAACAGACTTTCCTTG-3′,ALPF:5′-GAAGGTCGTACAACTGCTTATCC-3′,ALPR:5′-
GATTCCCACTGATTTGCCTGC-3′,EF1AF:5′-CGTCTGCCACTTCAGCATGTG-3′,EF1AR:5′ACTTGCAGGCGATGTGAGCAG-3′.
Assays were performed using a TProfessional thermocycler (Biometra).
SYBR-Green实时定量(q)RT-PCR分析
从8dpf的GF,CV或MO注射的幼虫中收获RNA,并如上所述产生cDNA。 在25μl反应中用对应于600 ng总RNA的cDNA和300nM基因特异性或对照引物进行qRT-PCR分析。 使用Primer Express 2.0软件(Applied Biosystems)设计基因特异性引物。Primer sequences are as follows; IAP151: 5′-GCCCTCACACTGCCTCTCA-3′, IAP233: 5′GAAACCGTGGACACTCCCATT-3′, TNF1F: 5′-TCCTCAGACCACGGAAAAGTG-3′,
TNF1R: 5′-CAACCCATTTCAGCGATTGTC-3′, TNF2F: 5′-
GCTGGATCTTCAAAGTCGGGTGTA-3′, TNF2R: 5′-
TGTGAGTCTCAGCACACTTCCATC-3′, EF1AF: 5′-
CGTCTGCCACTTCAGCATGTG-3′, EF1AR: 5′-ACTTGCAGGCGATGTGAGCAG-3′.
使用ABI Prism 7900HT序列检测系统(Applied Biosystems)一式三份进行测定。 将数据标准化至EF1A (ΔΔ Ct analysis, as described in the ABI User Bulletin #2, http://docs.appliedbiosystems.com/pebiodocs/04303859.pdf).
组织学
除非另有说明,否则将斑马鱼幼虫在4%多聚甲醛中固定过夜,包埋在石蜡中,然后切成7μm厚的切片并将其安装在载玻片上。 样品在带有Nomarski和荧光光学镜的尼康TE2000倒置显微镜上成像。 使用CoolSNAP相机(Photometrics)或QImage Micropublisher相机(QImaging Corp)获得数字图像。 使用Metamorph收集并分析图像,并在Adobe Photoshop中进行处理。 对苏木精和曙红(H&E)染色的7μm横切面进行了与LPS治疗相关的组织病理学分析。
原位杂交--将5 dpf幼虫在4%PFA中静置过夜,并在1XPBST中洗涤。 将整个山体幼虫平衡到HYB +缓冲液中(Westerfield,1993),并在65°C下预杂交4h。 根据Boehringer的说明书(目录号1175025)制备RNA探针,并将HYB +中的100 ng RNA探针在65°C加热60分钟。 幼虫与RNA探针杂交36h。 通过将幼虫在2XSSC中的70%的50%甲酰胺中浸泡30分钟,然后在70°C的2XSSC的溶液中漂洗30分钟,并在70°C的0.2XSSC的溶液中漂洗2次,以除去探针。 根据标准方案(Westerfield,1993)检测探针,并如前所述将幼虫切成薄片进行成像。
髓过氧化物酶--将幼虫在4%PFA中静置过夜,并在1XPBS中洗涤。 用髓过氧化物酶试剂盒(Sigma)对整个幼虫进行染色,以对中性粒细胞进行组织化学鉴定。 Mpo活性已被用作斑马鱼嗜中性粒细胞的标志物,尽管在嗜酸性粒细胞和红细胞中也观察到弱染色(Lieschke等,2001),因此要注意不要过度显影Mpo染色。 染色后,将幼虫用0.1%Tween的1XPBS洗涤,包埋在石蜡中,将7μm的横切面固定在载玻片上。 定量分析肠上皮中Mpo染色强的细胞,该区域位于距肛门140微米的肛门连续20个连续切片中。
微生物群计量和分析
为了比较myd88-MO和WT同科的微生物群,将这些胚胎放在底部为网眼的聚碳酸酯圆柱体中,并在共享的微生物水生环境中饲养在同一罐中。在8 dpf时,将动物用三卡因甲磺酸盐(MS222,Sigma)安乐死,并在无菌水中漂洗3次。将分别注入10 WT或myd88-MO的幼虫置于100μl无菌水中,匀浆,稀释并在胰蛋白酶大豆琼脂上培养以计数CFU并检查菌落形态。为了估计斑马鱼幼虫肠道中的细菌浓度,据此我们可以推断出LPS的浓度,我们测量了从已知细胞数(斑马鱼微生物群的一个主要成员)维罗纳氏菌生物变种的已知细胞中扩增出的16S rRNA基因的平均数量。大约4份/ CFU。根据我们之前对每条斑马鱼扩增的16S rRNA拷贝的测量结果(Bates等,2006),我们计算出每8 dpf幼虫的细菌载量约为4×105。如果将液体倒入幼虫的肠道,我们估计该器官的体积约为1至4 nl。
统计分析—重复进行AP活性测定,每次治疗至少进行两次试验,并使用两个样本的t检验对数据进行分析,并假设Excel中存在不相等的方差(Microsoft Office)。 存活曲线至少进行两次,每次处理总共合计至少30条鱼。 使用GraphPad Prism(Kaplan-Meier分析,GraphPad软件,http://www.graphpad.com)对存活曲线的数据作图和分析。 还使用GraphPad Prism(使用一个分组变量进行单向ANOVA的散点图)对中性粒细胞计数进行图形化和分析,并假设Excel中的方差不相等,使用两样本t检验进行中性粒细胞计数分析。
补充材料
有关补充材料,请参见PubMed Central上的Web版本。
致谢
We thank Rose Gaudreau and the staff of the University of Oregon Zebrafish Facility for fish husbandry, Poh Kheng
Loi for histology services, Mimi Shirasu-Hiza for assistance with statistical analysis, Tamara Pozos and Lalita Ramakrishnan for the gift of the myd88-MO, Hilary Clay for sharing unpublished information on the tnfr1-MO, members of the Guillemin lab for insightful discussions, and Sarah Cheesman, Hilary Clay, Tory Herman, Robin Lesley and Lalita Ramakrishnan for critical reading of the manuscript. This research was supported by NIH grants R21 DK067065-01 and R01 DK075549-01 and a Burroughs Wellcome Fund Career Award in the Biomedical Sciences (to K.G.). NIH grant HD22486 provided support for the Oregon Zebrafish Facility.
参考资料
Alpers DH, Zhang Y, Ahnen DJ. Synthesis and parallel secretion of rat intestinal alkaline phosphatase and a surfactant-like particle protein. The American journal of physiology 1995;268:E1205–1214. [PubMed: 7611397]
Bates JM, Mittge E, Kuhlman J, Baden KN, Cheesman SE, Guillemin K. Distinct signals from the microbiota promote different aspects of zebrafish gut differentiation. Developmental biology 2006;297:374–386. [PubMed: 16781702]
Bennett CM, Kanki JP, Rhodes J, Liu TX, Paw BH, Kieran MW, Langenau DM, Delahaye-Brown A, Zon LI, Fleming MD, et al. Myelopoiesis in the zebrafish, Danio rerio. Blood 2001;98:643–651. [PubMed: 11468162]
Berczi I, Bertok L, Bereznai T. Comparative studies on the toxicity of Escherichia coli lipopolysaccharide endotoxin in various animal species. Canadian journal of microbiology 1966;12:1070–1071. [PubMed: 5339644]
Beumer C, Wulferink M, Raaben W, Fiechter D, Brands R, Seinen W. Calf intestinal alkaline phosphatase, a novel therapeutic drug for lipopolysaccharide (LPS)-mediated diseases, attenuates LPS toxicity in mice and piglets. The Journal of pharmacology and experimental therapeutics 2003;307:737–744. [PubMed: 12970380]
Beutler B, Milsark IW, Cerami AC. Passive immunization against cachectin/tumor necrosis factor protects mice from lethal effect of endotoxin. Science 1985;229:869–871. [PubMed: 3895437]
Beutler B, Rietschel ET. Innate immune sensing and its roots: the story of endotoxin. Nature reviews 2003;3:169–176.
Cario E, Podolsky DK. Intestinal epithelial TOLLerance versus inTOLLerance of commensals.
Molecular immunology 2005;42:887–893. [PubMed: 15829278]
Cheesman SE, Guillemin K. We know you are in there: Conversing with the indigenous gut microbiota.
Research in microbiology 2007;158:2–9. [PubMed: 17223317]
Eckburg PB, Relman DA. The role of microbes in Crohn's disease. Clin Infect Dis 2007;44:256–262.
[PubMed: 17173227]
Erhard MH, Schmidt P, Zinsmeister P, Hofmann A, Munster U, Kaspers B, Wiesmuller KH, Bessler WG, Stangassinger M. Adjuvant effects of various lipopeptides and interferon-gamma on the humoral immune response of chickens. Poultry science 2000;79:1264–1270.
Feulner JA, Lu M, Shelton JM, Zhang M, Richardson JA, Munford RS. Identification of acyloxyacyl hydrolase, a lipopolysaccharide-detoxifying enzyme, in the murine urinary tract. Infection and
immunity 2004;72:3171–3178. [PubMed: 15155618]
Fishman WH, Green S, Inglis NI. L-phenylalanine: an organ specific, stereospecific inhibitor of human intestinal alkaline phosphatase. Nature 1963;198:685–686. [PubMed: 13945318]
Foreman JE, Blizard DA, Gerhard G, Mack HA, Lang DH, Van Nimwegen KL, Vogler GP, Stout JT, Shihabi ZK, Griffith JW, et al. Serum alkaline phosphatase activity is regulated by a chromosomal region containing the alkaline phosphatase 2 gene (Akp2) in C57BL/6J and DBA/2J mice. Physiological genomics 2005;23:295–303. [PubMed: 16159911]
Freudenberg MA, Meier-Dieter U, Staehelin T, Galanos C. Analysis of LPS released from Salmonella abortus equi in human serum. Microb Pathog 1991;10:93–104. [PubMed: 1716342]
Henning SJ. Ontogeny of enzymes in the small intestine. Annual review of physiology 1985;47:231– 245.
Hirschfeld M, Ma Y, Weis JH, Vogel SN, Weis JJ. Cutting edge: repurification of lipopolysaccharide eliminates signaling through both human and murine toll-like receptor 2. J Immunol 2000;165:618– 622. [PubMed: 10878331]
Iiyama R, Kanai T, Uraushihara K, Ishikura T, Makita S, Totsuka T, Yamazaki M, Nakamura T, Miyata T, Yoshida H, et al. Normal development of the gut-associated lymphoid tissue except Peyer's patch in MyD88-deficient mice. Scandinavian journal of immunology 2003;58:620–627. [PubMed: 14636418]
Inoue K, Takano H, Shimada A, Yanagisawa R, Sakurai M, Yoshino S, Sato H, Yoshikawa T. Urinary trypsin inhibitor protects against systemic inflammation induced by lipopolysaccharide. Molecular
pharmacology 2005;67:673–680. [PubMed: 15576631]
Ismail AS, Hooper LV. Epithelial cells and their neighbors. IV. Bacterial contributions to intestinal epithelial barrier integrity. American journal of physiology 2005;289:G779–784. [PubMed: 16227525]
Jault C, Pichon L, Chluba J. Toll-like receptor gene family and TIR-domain adapters in Danio rerio.
Molecular immunology 2004;40:759–771. [PubMed: 14687933]
Kasper, DL.; Harrison, TR. Harrison's principles of internal medicine. Vol. 16. New York: McGraw-Hill Medical Pub. Division; 2005.
Kawai T, Adachi O, Ogawa T, Takeda K, Akira S. Unresponsiveness of MyD88-deficient mice to endotoxin. Immunity 1999;11:115–122. [PubMed: 10435584]
Koyama I, Matsunaga T, Harada T, Hokari S, Komoda T. Alkaline phosphatases reduce toxicity of lipopolysaccharides in vivo and in vitro through dephosphorylation. Clinical biochemistry
2002;35:455–461. [PubMed: 12413606]
Le Du MH, Millan JL. Structural evidence of functional divergence in human alkaline phosphatases. The
Journal of biological chemistry 2002;277:49808–49814. [PubMed: 12372831]
Li-Chan E, Nakai S. Enzymic dephosphorylation of bovine casein to improve acid clotting properties and digestibility for infant formula. The Journal of dairy research 1989;56:381–390. [PubMed: 2760303]
Lieschke GJ, Oates AC, Crowhurst MO, Ward AC, Layton JE. Morphologic and functional characterization of granulocytes and macrophages in embryonic and adult zebrafish. Blood
2001;98:3087–3096. [PubMed: 11698295]
Lu M, Zhang M, Takashima A, Weiss J, Apicella MA, Li XH, Yuan D, Munford RS. Lipopolysaccharide deacylation by an endogenous lipase controls innate antibody responses to Gram-negative bacteria. Nature immunology 2005;6:989–994. [PubMed: 16155573]
Macpherson AJ, Geuking MB, McCoy KD. Immune responses that adapt the intestinal mucosa to commensal intestinal bacteria. Immunology 2005;115:153–162. [PubMed: 15885120]
Mathias JR, Perrin BJ, Liu TX, Kanki J, Look AT, Huttenlocher A. Resolution of inflammation by retrograde chemotaxis of neutrophils in transgenic zebrafish. J Leukoc Biol. 2006
Meijer AH, Gabby Krens SF, Medina Rodriguez IA, He S, Bitter W, Ewa Snaar-Jagalska B, Spaink HP. Expression analysis of the Toll-like receptor and TIR domain adaptor families of zebrafish. Molecular immunology 2004;40:773–783. [PubMed: 14687934]
Millán, JL. Mammalian alkaline phosphatases: from biology to applications in medicine and biotechnology. Weinheim: Chichester, Wiley-VCH; 2006.
Miller SI, Ernst RK, Bader MW. LPS, TLR4 and infectious disease diversity. Nat Rev Microbiol 2005;3:36–46. [PubMed: 15608698]
Munford RS. Detoxifying endotoxin: time, place and person. Journal of endotoxin research 2005;11:69– 84. [PubMed: 15949133]
Munford RS, Varley AW. Shield as signal: lipopolysaccharides and the evolution of immunity to gramnegative bacteria. PLoS Pathog 2006;2:e67. [PubMed: 16846256]
Nakano T, Inoue I, Koyama I, Kanazawa K, Nakamura K, Narisawa S, Tanaka K, Akita M, Masuyama T, Seo M, et al. Disruption of the murine intestinal alkaline phosphatase gene Akp3 impairs lipid transcytosis and induces visceral fat accumulation and hepatic steatosis. American journal of
physiology 2007;292:G1439–1449. [PubMed: 17332477]
Narisawa S, Huang L, Iwasaki A, Hasegawa H, Alpers DH, Millan JL. Accelerated fat absorption in intestinal alkaline phosphatase knockout mice. Molecular and cellular biology 2003;23:7525–7530. [PubMed: 14560000]
Pasparakis M, Alexopoulou L, Episkopou V, Kollias G. Immune and inflammatory responses in TNF alpha-deficient mice: a critical requirement for TNF alpha in the formation of primary B cell follicles, follicular dendritic cell networks and germinal centers, and in the maturation of the humoral immune response. The Journal of experimental medicine 1996;184:1397–1411. [PubMed: 8879212]
Pfeffer K, Matsuyama T, Kundig TM, Wakeham A, Kishihara K, Shahinian A, Wiegmann K, Ohashi PS, Kronke M, Mak TW. Mice deficient for the 55 kd tumor necrosis factor receptor are resistant to endotoxic shock, yet succumb to L. monocytogenes infection. Cell 1993;73:457–467. [PubMed: 8387893]
Poltorak A, He X, Smirnova I, Liu MY, Van Huffel C, Du X, Birdwell D, Alejos E, Silva M, Galanos C, et al. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene. Science 1998;282:2085–2088. [PubMed: 9851930]
Pressley ME, Phelan PE 3rd, Witten PE, Mellon MT, Kim CH. Pathogenesis and inflammatory response to Edwardsiella tarda infection in the zebrafish. Developmental and comparative immunology
2005;29:501–513. [PubMed: 15752547]
Pull SL, Doherty JM, Mills JC, Gordon JI, Stappenbeck TS. Activated macrophages are an adaptive element of the colonic epithelial progenitor niche necessary for regenerative responses to injury. Proceedings of the National Academy of Sciences of the United States of America 2005;102:99– 104. [PubMed: 15615857]
Rawls JF, Mahowald MA, Ley RE, Gordon JI. Reciprocal gut microbiota transplants from zebrafish and mice to germ-free recipients reveal host habitat selection. Cell 2006;127:423–433. [PubMed: 17055441]
Rawls JF, Samuel BS, Gordon JI. Gnotobiotic zebrafish reveal evolutionarily conserved responses to the gut microbiota. Proceedings of the National Academy of Sciences of the United States of America
2004;101:4596–4601. [PubMed: 15070763]
Renshaw SA, Loynes CA, Trushell DM, Elworthy S, Ingham PW, Whyte MK. A transgenic zebrafish model of neutrophilic inflammation. Blood 2006;108:3976–3978. [PubMed: 16926288]
Rothe J, Lesslauer W, Lotscher H, Lang Y, Koebel P, Kontgen F, Althage A, Zinkernagel R, Steinmetz M, Bluethmann H. Mice lacking the tumour necrosis factor receptor 1 are resistant to TNF-mediated toxicity but highly susceptible to infection by Listeria monocytogenes. Nature 1993;364:798–802. [PubMed: 8395024]
Sartor RB. Mechanisms of disease: pathogenesis of Crohn's disease and ulcerative colitis. Nature clinical practice 2006;3:390–407.
Savage DC. Microbial ecology of the gastrointestinal tract. Annu Rev Microbiol 1977;31:107–133.
[PubMed: 334036]
Schromm AB, Brandenburg K, Loppnow H, Zahringer U, Rietschel ET, Carroll SF, Koch MH, Kusumoto S, Seydel U. The charge of endotoxin molecules influences their conformation and IL-6-inducing
capacity. J Immunol 1998;161:5464–5471. [PubMed: 9820522]
Stoltz DA, Ozer EA, Ng CJ, Yu JM, Reddy ST, Lusis AJ, Bourquard N, Parsek MR, Zabner J, Shih DM. Paraoxonase-2 deficiency enhances Pseudomonas aeruginosa quorum sensing in murine tracheal epithelia. Am J Physiol Lung Cell Mol Physiol 2007;292:L852–860. [PubMed: 17122353]
Tuin A, Huizinga-Van der Vlag A, van Loenen-Weemaes AM, Meijer DK, Poelstra K. On the role and fate of LPS-dephosphorylating activity in the rat liver. American journal of physiology
2006;290:G377–385. [PubMed: 16223948]
Van Amersfoort ES, Van Berkel TJ, Kuiper J. Receptors, mediators, and mechanisms involved in bacterial sepsis and septic shock. Clinical microbiology reviews 2003;16:379–414. [PubMed:
12857774] van der Sar AM, Stockhammer OW, van der Laan C, Spaink HP, Bitter W, Meijer AH. MyD88 innate immune function in a zebrafish embryo infection model. Infection and immunity 2006;74:2436–
2441. [PubMed: 16552074] van Veen SQ, van Vliet AK, Wulferink M, Brands R, Boermeester MA, van Gulik TM. Bovine intestinal alkaline phosphatase attenuates the inflammatory response in secondary peritonitis in mice. Infection
and immunity 2005;73:4309–4314. [PubMed: 15972524]
Wallace KN, Akhter S, Smith EM, Lorent K, Pack M. Intestinal growth and differentiation in zebrafish. Mech Dev 2005;122:157–173. [PubMed: 15652704]
Waymire KG, Mahuren JD, Jaje JM, Guilarte TR, Coburn SP, MacGregor GR. Mice lacking tissue nonspecific alkaline phosphatase die from seizures due to defective metabolism of vitamin B-6. Nature genetics 1995;11:45–51. [PubMed: 7550313]
Westerfield, M. The zebrafish book a guide for the laboratory use of zebrafish Danio (Brachydanio) rerio. Eugene, OR: Institute of Neuroscience University of Oregon; 1993.
Xuan D, Nicolau DP, Nightingale CH, Quintiliani R. Circulating tumor necrosis factor-alpha production during the progression of rat endotoxic sepsis. Chemotherapy 2001;47:194–202. [PubMed: 11306788]
Youngner JS. Bacterial lipopolysaccharide: oral route for interferon production in mice. Infection and immunity 1972;6:646–647. [PubMed: 4628903]
Zambonino Infante JL, Cahu CL. Ontogeny of the gastrointestinal tract of marine fish larvae. Comp
Biochem Physiol C Toxicol Pharmacol 2001;130:477–487. [PubMed: 11738635]
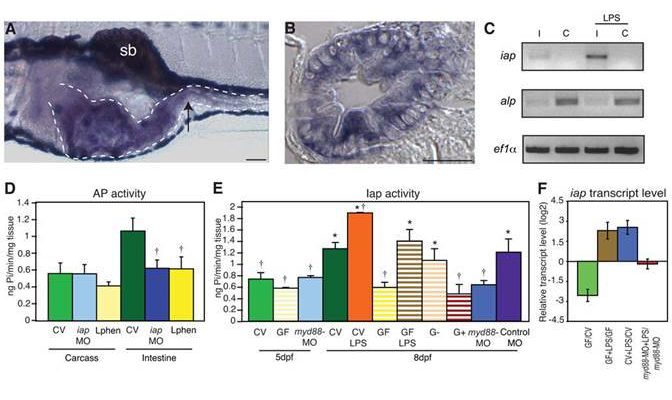
Figure 1.
Iap activity and iap transcription are regulated by LPS. In situ hybridization of iap transcript at 5 days post fertilization (dpf) in (A) a whole mount larva, and (B) a transverse section through the mid intestine (at the point indicated by the arrow in A). The iap specific purple stain is present in the intestinal epithelium (outlined with the dotted line in A) and is distinct from the black pigment cells above and below the digestive tract and the swim bladder (sb) in A. Scale bar in panel A = 100 μm, scale bar in panel B = 5 μm. (C) Semi-quantitative RT-PCR analysis showing iap and alp expression in dissected intestines (I) and carcasses from which intestines were removed (C) of 8 dpf larvae untreated or exposed to 50 μg/ml LPS for 24h. Levels of the housekeeping gene ef1α are shown as an amplification and loading control. (D) AP activity in the carcasses and intestines of 8 dpf untreated CV WT larvae, iap-MO injected larvae or larvae exposure to 10mM L-phen from 5 dpf. † Indicates values that differ significantly as compared to the CV levels of each group (carcass or intestine), P<0.01. (E) AP activity in 5 and 8 dpf intestines from larvae reared CV (solid bars) left untreated, exposed at 5 dpf to 30 μg/ml LPS, or injected at the 1 cell stage with myd88-MO or the control galT-MO, or larvae reared GF (striped bars) left untreated, exposed at 5 dpf to 3 μg/ml LPS, or mono-associated at 5 dpf with a Gram-negative Aeromonas species (G−) or a Gram-positive Streptococcus species (G+). † Indicates values that differ significantly from CV at 8dpf, * indicates values that differ significantly from GF at 8 dpf, P<0.01. For D and E, n=10 dissected intestines/treatment for each trial, with at least 2 trials per treatment. Error bars represent standard deviation. (F) iap transcript levels, measured by qRTPCR, were reduced in 8 dpf GF versus CV animals, and elevated in 8 dpf CV and GF animals exposed for 24h to 30 μg/ml LPS, but not in 8 dpf myd88-MO injected animals reared CV and exposed for 24h to 50 μg/ml LPS. Data are representative of two repeated trials, in which all samples were run in triplicate. Error bars indicate standard deviation. All animals were WT unless otherwise indicated.
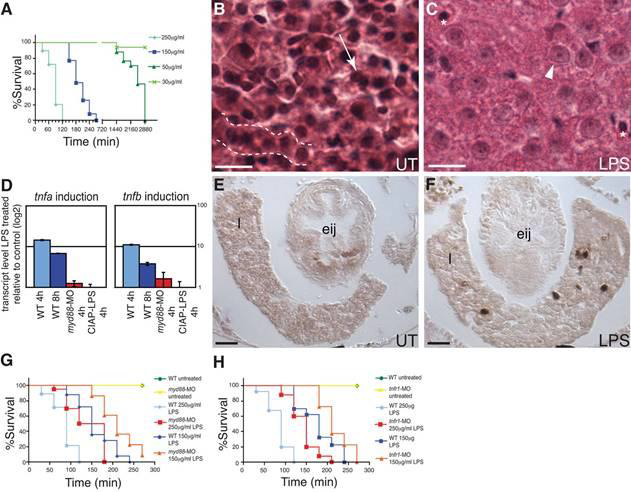
Figure 2.
LPS toxicity in zebrafish. (A) Dose-dependent killing of wild-type animals exposed to LPS at
6 dpf. Analysis of survival curves show they are significantly different (Logrank test,P<0.0001). (B–C) H&E stained liver sections of untreated (UT) 8 dpf larvae or exposed to 100μg/ml LPS for 24h. (B) Hepatocytes in B show typical organization in cords (dashed line) with distinct nuclei (arrow). (C) LPS treatment resulted in disorganized tissue morphology, with cell boundaries that are difficult to distinguish and swollen hepatocyte nuclei (arrowhead), in contrast to the normal-sized nuclei of red blood cells (asterisks). Scale bar in panel B,C = 5 μm. (D) tnfa and tnfb transcript levels, assayed by qRTPCR, in WT and myd88-MO injected 7 dpf larvae exposed to 50 μg/ml LPS for 4 or 8 h, or WT exposed to 50 μ/ml CIAP treated LPS for 4 h. Data are representative of two repeated trials, in which all samples were run in triplicate. Error bars indicate standard deviation. (E–F) Mpo stained transverse sections of UT 8 dpf larvae or larvae exposed to 150 μg/ml LPS for 2h at the esophageal-intestinal junction (eij). Mpo-positive cells (dark brown) are present in the liver (1) of the LPS exposed animal in F. Scale bar in panel E,F = 10 μm. (G–H) Survival curves of myd88-MO or tnfr1-MO injected 7 dpf larvae exposed to 150 or 250 μg/ml LPS. Survival curves are significantly different (Logrank test, P<0.0001). n = at least 30 total animals for each sample treatment in at least 2 independent trials. All animals were exposed to LPS at 7 dpf except those in panel A, which all began treatment at 6 dpf to allow for 48 h time period to observe toxic effects of low doses of LPS (30–50 μg/ml) prior to termination of all experiments at 8 dpf.
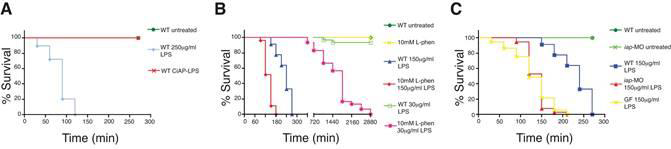
Figure 3.
Iap functions to detoxify LPS. (A) LPS pretreated with CIAP was non-toxic to zebrafish at 250 μg/ml LPS, in contrast to mock treated LPS. Inhibition of IAP activity using (B) L-phen, or (C) with iap-MO or by rearing larvae GF, significantly increased susceptibility of larvae to
LPS killing. Survival curves are significantly different (except WT untreated and WT CIAPLPS in A, WT untreated, 10mM L-phen and WT 30 μg/ml LPS in B, and iap-MO 150 μg/ml
LPS and GF 150 μg/ml LPS in C, Logrank test, P < 0.0001). All animals were administered LPS at 7 dpf except in panel B, where animals exposed to 30 μg/ml LPS began treatment at 6 dpf. All animals were reared CV, unless otherwise indicated. n = at least 30 total animals for each sample group, in at least two independent trials.
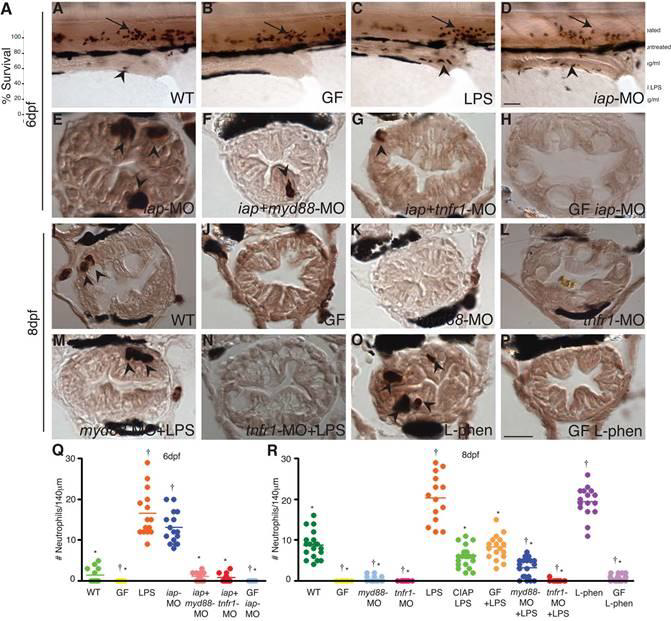
Figure 4.
Iap functions to prevent intestinal neutrophil infiltration in response to the microbiota. Whole mount larvae at 6 dpf (A–D) and transverse sections through distal zebrafish intestines at 6 dpf (E–H) and 8 dpf (I–P) with Mpo positive neutrophils visualized in dark brown in the intestinal epithelium (arrowheads) and posterior cardinal vein (arrows); (black cells surrounding the intestinal epithelium are pigment cells.) The WT intestine contained low numbers of neutrophils at 6 (A) and 8 dpf (I), whereas GF intestines were devoid of all neutrophils (B,J). Neutrophil numbers increased significantly upon exposure to 150 μg/ml LPS for 2h (C) or with inhibition of endogenous Iap with iap-MO (D,E) or L-phen (O). Neutrophil infiltration was inhibited in myd88-MO (K) or tnfr1-MO injected larvae (L), even upon exposure to 150 μg/ ml LPS for 2h (M–N) or co-injection with iap-MO (F–G). In the absence of microbiota, Iap inhibition did not induce neutrophil influx (H,P). All animals were reared CV unless otherwise indicated. Scale bar in panel D (A–D) = 50 μm, scale bar in panel P (E–P) = 5 μm. (Q–R) Quantification of neutrophils per 140 μm of distal intestine, n = at least 13 animals per treatment; bar indicates average value for each group. † indicates values that differ significantly from WT, * indicates values differ significantly from WT LPS treated, P < 0.01. One-way analysis of variance (ANOVA) show treatments differ significantly, (Q) F = 99.24, P < 0.0001 (R) F = 142.7, P < 0.0001.
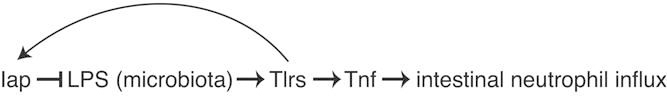
Figure 5.
A model of Iap function in the intestinal epithelium. Iap is induced by microbiota-associated LPS and dephosphorylates this LPS, thereby establishing a homeostatic negative feedback loop that reduces signaling through Tlrs and Tnf and prevents excessive intestinal inflammation.
2俄勒冈大学分子生物学研究所,尤金, OR 97403,美国
纲要
脊椎动物的肠道菌群中含有丰富的脂多糖(LPS)或内毒素。我们证明,刷状缘酶-肠碱性磷酸酶(Iap)在斑马鱼肠道菌群形成过程中被诱导从而在促进黏膜对肠道细菌的耐受中起着关键作用。我们证明,iap缺乏的动物对lps的毒性反应是通过Myd88和肿瘤坏死因子受体(Tnfr)介导的机制来感应的。我们进一步证明,内源性微生物群通过一个涉及myd88和tnfr的过程建立了肠道中性粒细胞的正常稳态水平。iap缺乏的动物表现出过多的肠道中性粒细胞流入,类似暴露于lps的野生型动物。但在无细菌饲养的情况下,缺乏Iap的动物的肠道内缺乏中性粒细胞,这表明iap具有防止肠道细菌炎症反应的功能。
介绍
lps是所有革兰氏阴性细菌(包括病原体和共生菌)外膜的主要成分,作为一种细菌相关物质被单独发现,称为内毒素,可引起动物感染性休克(Beutler and Rietschel, 2003) 。我们现在知道lps通过过度刺激toll样受体(toll-like receptor,tlr)固有免疫信号发挥毒素作用,从而诱导致病性炎症反应。缺乏内毒素特异性TLR4或TLRs下游常见适配器MYD88的小鼠对内毒素毒性的抵抗力增强(Kawai et al., 1999; Poltorak et al.,1998) 。TLR信号通过myd88促进nf-κb的核移位和肿瘤坏死因子(tnf)等促炎细胞因子的转录。TNF是脓毒性休克的重要介质,在用TNF阻断抗体治疗的小鼠中观察到的内毒素抵抗证明了这一点(Beutler et al., 1985)。TNF也并不是LPS毒性的唯一介质,事实表明,缺乏TNFα的小鼠(Pasparakis等人,1996年)、其主要受体TNFRP55(Pfeffer等人,1993年)或其75和55 kD受体(Rothe等人,1993年)与野生型小鼠一样,对高剂量的LPS腹腔注射敏感。h它们对低剂量的脂多糖和肝细胞毒素dgalactosamine有更强的抵抗力。TNF和其他促炎性细胞因子诱导血管通透性,血流和中性粒细胞募集进入LPS来源,以及全身反应,例如发烧,在感染性休克的极端情况下,弥散性血管内凝血,低血压甚至最终导致器官功能障碍。
脊椎动物体内lps最丰富的来源之一是肠道菌群。自从发现识别病原体和宿主有益微生物分子特征的先天免疫信号途径以来,一个尚未解决的问题就是为什么肠道微生物群落不会在宿主体内引发病理性炎症。事实上,对微生物群的不当炎症反应在炎症性肠病患者中表现出来(Sartor,2006)。在健康个体中,提倡的保护机制包括从肠上皮分离iga涂层的肠道微生物(macpherson等人,2005年)、肠上皮的屏障功能和肠上皮细胞中固有免疫受体的限制性表达(cario和podolsky,2005年)。
除了通过隔离促炎配体及其受体来限制先天免疫信号外,宿主细胞还可以通过改变促炎微生物分子本身来主动调节炎症反应。这种机制已在一种酰基氧基水解酶的情况下被证明,该酶从脂类lps的一部分裂解酰基链(feulner等人,2004)。在缺乏这种酶的小鼠中,酰化脂多糖在感染革兰氏阴性病原体后持续较长时间,并导致B细胞增殖和抗体产生增加(Lu等人,2005)。碱性磷酸酶(AP)也被证明通过使脂类A部分去磷酸化来修饰脂多糖(Beumer等人,2003;Koyama等人,2002;Tuin等人,2006;Van Veen等人,2005)。脂类A是脂多糖的毒性成分,它含有两个与葡萄糖胺结合的磷酸基团;除去其中一个磷酸基团可生成一个磷酰脂类A,其毒性比未经修饰的脂类A低100倍(Schromm等人,1998)。
在脊椎动物中,aps广泛分布于不同的器官,但其生理基础在很大程度上未知。缺乏普遍表达的组织非特异性AP(TNAP)的小鼠因磷酸吡哆醛代谢缺陷而死于癫痫发作(Waymire等人,1995),论称维生素B-6是小鼠TNAP的天然底物。肠道特异性同工酶(iap)一直是肠上皮细胞成熟的标志物,但其在肠内的生理功能尚不清楚。蛋白质定位于顶端刷缘,富含表面活性剂样颗粒,分泌到肠腔(Alpers等人,1995)。这种酶的活性急剧增加发生在哺乳动物和鱼类胚胎后发育期间,即肠道微生物群建立的时期(Bates等人,2006年;Henning,1985年;Zambonino Infante和Cahu,2001年)。IAP被认为在酪蛋白的消化和吸收中起作用(Li Chan和Nakai,1989)。然而,缺乏iap的小鼠没有明显的消化缺陷,并且实际上表现出脂肪滴通过肠壁的加速运输,当喂食高脂肪饮食时会导致肥胖(nakano等人,2007;narisawa等人,2003)。
我们假设Iap作用于与肠道细菌相关的去磷酸脂多糖,从而调节肠道炎症反应,以应对常驻微生物群。我们用斑马鱼模型测试了这个想法,因为可以比较容易的使用无菌生物学操作和控制细菌关联,利用吗啉反义寡核苷酸(mos)来操纵宿主基因表达。硬骨鱼类和哺乳动物消化道的发育和生理学非常相似(Wallace等人,2005年),两者都对其常驻微生物群有保守的反应(Cheesman和Guillemin,2007年)。我们实验显示斑马鱼像哺乳动物一样,通过涉及Myd88和Tnfr的机制对LPS做出反应。我们报道定居后,肠道微生物通过与外源性LPS相似的机制引起低水平的肠道炎症。最后,我们证明了Iap功能对于解脂LPS和防止肠道炎症反应是必需的。
斑马鱼肠道内碱性磷酸酶基因的鉴定
在先前的工作中,我们显示了在受精后(dpf)5至8天之间,该器官被微生物定殖的期间斑马鱼肠中的刷状缘AP活性增加,但在饲养GF的动物中却没有增加(Bates等,2006)。我们发现,通过用常规饲养(CV)对照中的菌群接种5 dpf GF斑马鱼,我们可以将正常Iap水平恢复8 dpf。此外,我们证明lps暴露足以诱导GF动物中Iap的活性。为了研究LPS调节Iap的机制和功能意义,我们试图鉴定斑马鱼的Iap基因。人类的AP由四个基因座编码:1号染色体上的TNAP和组织特异性同功酶IAP,胎盘AP和生殖细胞AP,它们聚集在染色体2q37的位置,似乎是由串联重复产生的(Millán,2006)。为了分离斑马鱼中的iap基因,我们将编码IAP的鼠Akp3序列(登录号:M61705.1)与斑马鱼基因组进行了比较,该基因组产生了两个碱性磷酸酶基因,分别位于11和22号染色体。与人类相似,这些ap基因是高度相关,但其表达方式而有所不同(Le Du和Millan,2002)。与注释为碱性磷酸酶(alp)的11号染色体ap转录本(登录号:NM_201007)的原位杂交在5 dpf处表现出低水平的普遍表达(数据未显示)。 相比之下,与鼠Akp3共享75%序列同一性的无注释染色体22 ap基因(登录号:NM_001014353)在5 dpf幼虫的肠上皮中特异性表达(图1A,B)。 对来自8 dpf幼虫的解剖肠进行RT-PCR分析,显示了肠22号ap基因的特异性表达,而11号ap染色体的转录在肠中以及在被我们去除肠的样本中的含量都很低(图 1C)。
接下来,我们通过用特定于该基因的剪接阻断MO来阻断该基因的表达来测试该基因是否编码了斑马鱼肠中的AP活性(图S1A)。当饲养到8 dpf时,与野生型(WT)肠相比,注射iap-MO的动物的肠表现出显着降低的AP活性(图1D)。 Iap-MO特异地抑制了肠道中AP的活性,并且没有改变缺乏肠道的cas体中的AP活性(图1D)。我们观察到从5 dpf浸入10mM L-苯丙氨酸(L-phen)(一种IAP同工酶的特异性抑制剂)的溶液中,对8 dpf的鱼具有类似的肠道特异性抑制活性(Fishman等,1963)(图1D)。用抗α,3半乳糖基转移酶(galT)基因的对照MO处理不会改变Iap活性(图1E)。根据这些结果,我们将22号染色体ap基因指定为斑马鱼肠道碱性磷酸酶(iap)。来自注射iap-MO的动物的肠道保留了一些AP活性,这可能是由于在这些动物中存在一些WT iap转录物表明,在8 dpf时iap-MO的抑制作用不完全(图S1A)。此外,由于iap-MO对5 dpf肠的总AP活性没有抑制作用,但对8 dpf肠的AP活性却降低了,因此肠道中的某些AP活性很可能是由无处不在的alp基因编码的(图S1B ),尽管在更早的时间点可以更有效地阻止IAP转录剪接(数据未显示)。
细菌脂多糖对斑马鱼Iap转录的调节
我们以前曾报道过,纯化的LPS浓度为3μg/ ml,足以在GF幼虫中诱导Iap活性达到CV对照水平(Bates等,2006)。在这里,我们测试了Iap活性是否可以被其他LPS进一步诱导。我们观察到,暴露于30μg/ ml LPS的CV幼虫的Iap活性显着高于未处理水平(图1E)。如我们先前所示,GF幼虫与来自斑马鱼肠的革兰氏阴性细菌分离株(气单胞菌和假单胞菌属)单缔合足以诱导Iap活性达到CV水平,但是当我们将GF幼虫与数个革兰氏单亲结合时阳性分离株(链球菌和葡萄球菌)在其细胞壁上缺乏LPS,我们没有观察到Iap活性的诱导(图1E和数据未显示)。这些结果表明,LPS足以在斑马鱼中诱导Iap活性。
为了了解Iap诱导的机制,我们检查了CV和GF幼虫中Iap转录本的程度。半定量RT-PCR显 示,暴露于50μg/ ml LPS 24h后,肠道中的iap转录水平增加,而在整个处理过程中,整个生 物体中alp的转录均保持不变(图1C)。使用定量逆转录PCR(qRT-PCR),我们发现,类 似于Iap酶活性的调节,在细菌存在下,iap转录水平显着提高(图1F)。此外,暴露于外源LPS(30μg/ ml,持续24小时)足以增加GF幼虫的Iap转录水平,并使Iap高于CV幼虫的 正常水平(图1F)。
细菌对Iap活性的调节依赖于Myd88
响应LPS的Iap的诱导表示该基因受Tlr信号传导调控的可能性。在斑马鱼基因组中已经鉴定出几种Tlr4直向同源物和一个编码Myd88的单一基因(Jault等,2004; Meijer等,2004)。为了测试Myd88对于LPS诱导Iap是否重要,我们使用了剪接阻断MO来斑马鱼myd88(图S1C)。注入myd88-MO的鱼没有表现出明显的形态缺陷(数据未显示),与斑马鱼用不同的myd88-MO(van der Sar等,2006)和Myd88-/-小鼠(Iiyama等, 2003)。为了测试Myd88是否需要Iap活性的幼虫上调,我们从myd88-MO注射的幼虫中解剖了肠,并分析了组织的AP活性。尽管在5 dpf时CV或GF WT动物之间,myd88-MO注射动物肠道的AP活性是无法区分的,但在肠道细菌定殖开始时,myd88-MO注射幼虫的肠道AP活性却没有增加8 dpf,与GF WT动物相似(图1E),表明CV动物中Iap的微生物群依赖性诱导是Myd88依赖性的。接下来,我们调查了Myap88依赖方式是否通过外源LPS调节了Iap转录本的程度。使用qRT-PCR,我们发现用myd88-MO注射的幼虫用50μg/ ml纯化的LPS处理24小时无法增加IAP(图1F),表明Myd88是LPS介导的IAP诱导所必需的。
脂多糖对斑马鱼的致毒
摄入或腹腔注射高剂量的脂多糖对哺乳动物是有毒的(van Amersfoort等人,2003)。脊椎动物对脂多糖毒性表现出广泛的敏感性:与大鼠和小鼠相比,小牛非常敏感,而鱼和青蛙更具抵抗力(Berczi等人,1966年)。我们发现,将6 dpf斑马鱼幼虫浸泡在含有高浓度LPS的水中会导致死率、存活率和杀灭动力学与LPS剂量成正比。5dpf的幼虫对lps的杀灭更有抵抗力,这可能是由于tlr信号通路基因的表达减少,在某些情况下,tlr信号通路基因的表达具有动态的发育表达谱(jault等人,2004)。在6dpf时,30μg/ml lps剂量不能致死,50μg/ml剂量在48小时能达到 100%死亡率,150μg/ml剂量在4.5小时达到 100%死亡率,250μg/ml剂量导致2小时内100%幼虫死亡(图2a)。与哺乳动物相似,暴露于脂多糖的斑马鱼也表现出器官衰竭,表现为心跳和嗜睡减少,以及水肿和血池,这可能是严重心动过缓的结果(数据未显示)。
Lps毒性在哺乳动物中具有典型的组织病理学特征,包括肝脏、心脏和肠道的损伤,以及受感染的水肿和中性粒细胞浸润。对斑马鱼幼鱼暴露于100μg/ml脂多糖24小时并在死亡前处死的肝脏进行组织学分析,发现肝细胞肿胀、紊乱(图2c)和髓过氧化物酶(MPO)阳性中性粒细胞浸润(图2f),与脂多糖致敏小鼠的病理报告相似(Inoue等人,2005)。与lps中毒的哺乳动物一样,我们还观察到mpo阳性中性粒细胞在lps处理的幼虫体内的肠道浸润,如下所述。
LPS毒性在哺乳动物中的一个特征是诱导高水平的促炎性细胞因子Tnf转录。用50μg/ ml LPS处理的7 dpf幼虫的qRT-PCR分析显示了两种斑马鱼tnf直向同源物的显着瞬时诱导,在暴露后4h诱导达到较高水平,到8h后显着下降(图2D)。在LPS诱导的大鼠菌血症模型(Xuan等,2001)和斑马鱼胚胎中,革兰氏阴性鱼病原菌爱德华氏菌感染的菌血症模型中观察到了类似的瞬时Tnf诱导(Pressley等,2005)。
LPS毒性在哺乳动物中的另一个特征是TLR和TNF信号的参与。我们发现,注入myd88-MO的幼虫在LPS暴露后表达的tnf转录物水平较低(图2D)。此外,在两种不同的LPS浓度下,myd88-MO注射的幼虫对LPS杀灭的抵抗力明显更高(图2G,Logrank测试,P <0.0001)。为了测试Tnfr在对LPS响应中的可能作用,我们使用了对斑马鱼tnfr1进行剪接阻断的MO(图S1D)。在两种不同的LPS浓度下,注射tnfr1-MO的鱼类对LPS的抵抗力也比野生型鱼类明显更高(图2H,Logrank测试,P <0.0001)。注射myd88-和tnfr1-MO的幼虫均服从LPS治疗,尽管动力学较慢,这可能分别是由于Myd88和Tnfr对LPS毒性的独立机制以及MOs不完全抑制所致(图S1C,D)。
Iap可防止LPS毒性
我们假设内源性iap的作用是解毒肠上皮细胞遇到的lps。首先,我们通过将7只dpf幼虫暴露于250μg/ml lps(已用纯化的小牛肠道碱性磷酸酶(ciap)预处理)中,来测试去磷酸化lps是否与哺乳动物细胞一样具有较少的促炎性和较少的毒性(koyama等人,2002)。去磷酸化脂多糖未能诱导TNF或IAP的表达(图2D,数据未显示),对斑马鱼完全无毒,而相同剂量的模拟处理脂多糖在2小时内造成100%的致死率(图3A)。
接下来,我们测试了Iap活性降低的斑马鱼对LPS的敏感性是否增加。通过将5个DPF幼虫浸泡在10毫米L-phen溶液中或注射IAP-mo抑制IAP,可显著提高对LPS的敏感性(图3B、C)。给6只dpf-wt幼虫注射30μg/ml lps,48小时内死亡率不高,而用10mml l-phen在4dpf下预处理,然后用lps在6dpf下暴露,48小时内死亡率为100%(图3b,logrank检验,p<0.0001)。单用左旋苯处理的对照幼虫在同一时期未显示出致死性(图3B)。在7dpf条件下,当暴露于150μg/ml lps时,经l-phen处理的幼虫也明显比wt幼虫更敏感(图3b,logrank,p<0.0001)。同样,注射iapmo的幼虫对lps处理更为敏感,在7dpf时给予150μg/ml剂量,死亡率约为90%,而对照动物的存活时间更长(图3c,logrank检验,p<0.0001)。最后,我们观察到降低iap活性的gf动物(见图1e)对150μg/ml lps的敏感性也增加(图3c,logrank检验,p<0.0001)。这些数据共同表明,内源性Iap可以针对生物学上相关范围的外源性LPS浓度提供保护。
微生物群调节肠道中性粒细胞的稳态数量
我们接下来验证Iap是否在调节肠道对lps的炎症反应中起作用。我们发现在gf和cv 8-dpf幼虫之间,肿瘤坏死因子转录的水平没有变化,但这不足为奇,因为这些基因响应促炎性刺激(图2D)或菌血症激发而表达的瞬时特性(Pressley等, 2005年)。我们描述了肠道内中性粒细胞稳态对微生物群定植的响应。MPO被用作斑马鱼粒细胞或中性粒细胞的标记物,这些粒细胞或中性粒细胞已被证明渗透到与哺乳动物中性粒细胞相似的伤口部位(Bennett等人,2001;Lieschke等人,2001;Mathias等人,2006;Renshaw等人,2006)。与gf斑马鱼6dpf幼虫相比,cv的肠道中mpo转录水平升高(rawls等人,2004)。我们计数了幼虫肠道远端140μm的mpo阳性中性粒细胞,观察到这些细胞的优势分布。我们发现,在该器官的微生物定殖过程中,肠道中Mpo阳性中性粒细胞的平均数量增加,远端肠中平均2个中性粒细胞为6 dpf CV幼虫,到8 dpf时平均增加到平均7个中性粒细胞(图4Q ,R)。相比之下,GF肠在6和8 dpf时完全没有Mpo阳性中性粒细胞,表明中性粒细胞被吸收到肠道以响应微生物群(图4Q,R)。
我们接下来研究了肠道中性粒细胞募集的机制。我们发现,150μg/ml lps暴露2小时后,mpo阳性的肠中性粒细胞显著增加(6 dpf中17个,8 dpf-cv幼虫中22个,图4d,e,q,r)。相比之下,暴露于150μg/ml经ciap处理的lps中2小时未能引起8只dpf幼虫中性粒细胞的任何增加(图4r)。根据我们的结果显示,myd88和tnfr1在其它lps反应中的重要性,我们测试了myd88 mo或tnfr1-mo是否能抑制肠道中性粒细胞的募集,我们发现myd88mo注射的幼虫在饲养cv时没有mpo阳性的肠道中性粒细胞,并且显著减少了lps的数量。这些细胞暴露于脂多糖(图4k,m,r)。同样,当饲养cv和暴露于lps时,注射tnfr1-mo的幼虫肠道上皮中缺乏mpo阳性中性粒细胞(图4l,n,r)。我们的研究结果表明,tlr和tnf信号在中性粒细胞流入肠道的过程中,对促炎性刺激以及由常驻微生物群建立的肠道中性粒细胞的稳态水平都起着作用。
Iap可防止对常驻微生物群的炎症反应
接下来,我们检查了Iap在调节对微生物群的肠道炎症反应中的作用。在这些实验中,我们要么用iap-MO抑制6 dpf的Iap(当剪接阻断更有效时,数据未显示),要么用L-phen抑制8 dpf。我们发现,以6 dpf的剂量通过iap-MO注射的幼虫或以8 dpf的剂量进行L-phen处理的幼虫中Mpo阳性肠中性粒细胞的数量显着大于野生型对照,并且与暴露于LPS的幼虫中的数量相似(图4C ,F,O,Q,R)。接下来,我们测试了中性粒细胞的流入是否由与暴露于LPS或微生物群的野生动物相同的基于Myd88和Tnfr1的机制介导。在双倍注射了iap-和myd88-MOs(图4G,Q)或iap-和tnfr1-MOs(图4H,Q)的幼虫中,肠道Mpo阳性中性粒细胞数量大大减少(图4Q) Iap在Myd88和Tnfr1的上游起作用。最后,为了证明iap功能是必需的上游促炎化合物与常驻微生物群,我们检查了在没有微生物的情况下饲养的iap缺陷幼虫的中性粒细胞数量。当在生长因子条件下饲养时,iap-mo注射的6只dpf幼虫和l-phen处理的8只dpf幼虫的肠上皮中mpo阳性中性粒细胞数量非常低(图4h,p,q,r)。野生型gf肠道能够募集中性粒细胞,这一点可以从这些动物对lps暴露的强烈中性粒细胞流入中得到证明(图4r)。这些结果表明,gf-iap缺乏的幼虫缺乏肠道中性粒细胞,因为它们缺乏iap的促炎症基质,这与内源性iap对肠道细菌相关lps的解毒作用是一致的。
探讨
利用GF斑马鱼模型,我们发现LPS在肠道细菌定植期间诱导Iap活性(bates等人,2006)。哺乳动物Iap是肠上皮细胞分化的标志物,但其内源性底物尚不清楚。Iap能够使许多不同的LPS血清型脱磷(tuin等人,2006),这是一种产生无毒分子形式的反应。我们测试了一种假设,即斑马鱼的Iap可以解毒与肠道细菌相关的LPS。
已知lps及其信号传导的下游产物对哺乳动物有毒性,但此前这种反应还未在斑马鱼中被发现过。我们报道了LPS治疗斑马鱼导致剂量依赖性死亡、器官衰竭、肝细胞肿胀和中性粒细胞浸润等特征性组织病理学改变以及炎性细胞因子、tnfa和tnfb的动态转录诱导。斑马鱼和小鼠间的LPS致死剂量是很难比较的,因为我们使用了水源给药途径,这会导致LPS摄入以及皮肤和鳃的暴露。在8dpf斑马鱼幼体肠道内,我们估计大约有4×105个细菌,其中大部分为革兰氏阴性,在大约1至4nl的体积内,导致大约1011/ml的细菌浓度,类似于人类结肠的细菌浓度(savage,1977)。根据沙门氏菌的总内毒素和脱落内毒素的测量(Freudenberg等人,1991年),该细菌密度将斑马鱼肠道中总内毒素的浓度定为mg/ml,脱落内毒素的浓度定为几十μg/ml,在本研究使用的浓度范围内。在败血性休克的小鼠模型中,LPS通常以约50 mg / kg体重的剂量腹膜内给药以达到100%的致死率,并且口服时毒性降低约10倍(Youngner,1972)。我们表明,在斑马鱼中,与在哺乳动物中一样,通过抑制Myd88和Tnfr可以改善LPS的毒性。此外,用纯化的CIAP预处理LPS使其对斑马鱼完全无毒。最后,我们证明了通过药理作用或基因特异性MO抑制内源性Iap会导致对LPS毒性超敏反应。
为了测试这种酶在预防炎症反应中对微生物群的作用,我们研究了中性粒细胞进入肠道的调节。我们发现肠道上皮中Mpo阳性中性粒细胞的稳态数量是由微生物群建立的,而GF幼虫缺乏所有这些细胞。我们没有发现 巨噬细胞参与肠道微生物或外源性脂多糖的炎症反应的证据。从GF、CV和LPS暴露的鱼的解剖内脏中分离的RNA显示出Mpo水平与肠道中性粒细胞数量相关的显著差异,而我们观察到这些样本之间巨噬细胞特异性基因、集落刺激因子1受体的转录水平没有差异(未发表的结果)。我们证明,在微生物群定植时建立肠道免疫细胞内稳态使用相同的蛋白质,myd88和tnfr1,它们促进肠道炎症对外源性lps的反应。这些结果表明先天免疫信号在黏膜免疫成熟中的重要性,类似于在myd88缺陷小鼠的肠道相关淋巴组织中观察到的细微发育缺陷(iiyama等人,2003)。在小鼠中,已证明myd88功能仅在髓细胞而不是肠上皮细胞中被要求用于对肠损伤的微生物依赖性反应(Pull等人,2005)。确定斑马鱼肠中myd88功能的细胞分布和需求将是一个有趣的课题。
微生物群通过与内毒素类似的机制引发肠道炎症的能力,突出了宿主策略的重要性,即选择合适的微生物群落(在某些炎症性肠病中可能会出错的过程(Eckburg和Relman,2007))和限制该群落的炎症影响。事实上,抑制先天性免疫反应(如myd88介导的免疫反应)可能改变肠道微生物群落,从而间接导致肠道炎症的减少。然而,当我们将注射MYD88MO的微生物群和在同一水中一起饲养的对照幼虫培养时,我们观察到两组之间的细菌负荷或菌落形态没有显著差异(未公布的结果),这与微生物群的变化是导致MPO阳性中性粒细胞在小鼠体内缺失的原因相矛盾。
通过描述在有无微生物条件下Iap缺陷饲养鱼的中性粒细胞浸润,我们发现Iap作用于与微生物群相关的促炎信号上游。总之,我们的结果表明,在定植过程中被微生物群上调的Iap具有解毒微生物群相关lps的功能,从而建立一个稳态负反馈回路,防止tlr和tnf信号过量和肠道炎症(图5)。因此,Iap在限制常驻肠道微生物的促炎症潜能和促进粘膜对占斑马鱼微生物群很大比例的革兰氏阴性菌的耐受性方面发挥着重要作用(bates等人,2006;rawls等人,2006)。
重要的是,iap酶活性高度局限于顶部肠上皮(bates等人,2006),因此其lps解毒活性预计不会影响宿主对穿透肠上皮屏障的革兰氏阴性病原体的检测。除了刷状边界定位外,哺乳动物的iap也被证明是由肠细胞分泌的(alpers等人,1995),这增加了这种酶可能具有肠外活性的可能性,正如研究表明,在大鼠静脉注射纯化的小牛iap,然后注射lps后,肝细胞减少。与单纯注射脂多糖的对照大鼠相比的损伤(Tuin等人,2006年)。正如免疫系统在不同组织中的精细化一样,微生物产品的局部修饰可能代表微生物-宿主相互作用的一个未被充分认识的方面。宿主脂多糖毒性酰氧基水解酶(AOAH)在肾皮质的局部表达和分泌到尿液中可能有助于保护尿路免受革兰氏阴性菌的过度炎症反应(Munford,2005)。值得注意的是,在鱼类基因组中没有发现aoah同系物(munford和varley,2006),这表明其他lps解毒机制,如涉及aps的机制,可能在这些物种中发挥更重要的作用。在肺上皮细胞中表达的另一种宿主酶,哺乳动物乳糖酶,对氧磷酶-2(pon2),已被证明可降解细菌群体感应高丝氨酸内酯自诱导物,并干扰铜绿假单胞菌气管感染所需的信号机制(stoltz等人,2007)。在这里,我们已经证明Iap是另一种大量的宿主酶,用于修饰特定组织遇到的细菌信号。目前正在进行实验,以验证Iap在防止哺乳动物对微生物群的炎症反应方面的功能是否是保守的。
人类对脂多糖表现出广泛的反应。这种表型多样性的可能机制包括人类群体中TLR4基因的广泛多态性,对脂多糖反应较弱的TLR4等位基因与更高的肠道细菌感染发病率相关,但与慢性炎症相关的疾病风险降低(Miller等人,2005)。在哺乳动物AP基因中也存在相当程度的遗传多样性(MARAMAN),AKP2等位基因变体,编码TNAP,已被证明在小鼠中调节血清AP活性(Furman等),提示IAP基因的变化有助于LPS应答的可能性。iap活性的发育变异也可能对人类健康产生重要影响。例如,由于缺乏IAP活性,患坏死性小肠结肠炎的婴儿的早产儿可能会出现严重的炎症反应。
细菌-动物共生的特点是合作伙伴之间仔细协商,以优化其共享环境。互惠信号存在于这些相互作用中,微生物信号调节宿主过程,然后直接或间接影响微生物群的组成或活动。微生物肠道菌群已经被证明可以通过抑制k途径中的多个步骤来主动抑制炎症(Ismail和Hooper,2005),这里我们展示了斑马鱼中许多肠道菌群共有的一个信号,lps,上调iap,其功能是防止过度的肠道炎症,这一反应将有害于微生物群和宿主相似。
实验步骤
无菌斑马鱼养殖
所有实验的斑马鱼均遵循俄勒冈大学动物护理机构和使用委员会批准的实验方案并符合标准实验方案(Westerfield,1993)。如前所述(Bates等,2006),产生了CV,GF和与单缔合的幼虫,并评估了GF胚胎的无菌性。为了得到注射GF Iap-MO的动物,按照标准程序(Westerfield,1993),通过体外受精产生了胚胎,除了使用先前所述的抗生素胚胎培养基(Bates等,2006)使卵受精,然后如下所述注射iap-MO。然后按照先前的描述(Bates et al。,2006)将注射的胚胎衍生为GF,不同的是将0.003%的次氯酸钠浸泡的时间从30分钟减少到20分钟,另外将胚胎浸泡在0.1%的聚乙烯基吡咯烷酮碘2分钟。用于单分子生物学的细菌是斑马鱼分离株veronii veronii biovar sobria,荧光假单胞菌(Bates等,2006),链球菌和葡萄球菌菌株(未发表数据)以及从小鼠分离出的链球菌,它们定居在斑马鱼上(Rawls等,2006 )。通过将细菌培养物注射到GF 5 dpf幼虫的烧瓶中以达到106个菌落形成单位(CFU)/ ml的最终浓度来产生单关联动物,该细菌在8 dpf幼虫中的最终细菌载量与8 dpf CV幼虫相当((Bates等,2006)和未发表的数据)。
脂多糖和L-苯丙氨酸治疗
除非另有说明,通常情况下将经过LPS过滤器灭菌的溶液在7dpf(大肠杆菌血清型0111:B4,Fluka)注入GF和CV幼虫的最终浓度为3–250μg/ ml的烧瓶中。值得注意的是,从sigma购买的LPS产生了不同程度的结果,而从fluka购买的4个不同批次的lps给出了可重复的结果。商业来源的脂多糖含有微量的肽聚糖(pgn)和脂蛋白污染物(Hirschfeld等人,2000年)。为了测试lps是否是由pgn污染引起的,我们将7条dpf斑马鱼幼鱼暴露于高达1 mg/ml的纯化pgn(金黄色葡萄球菌77140,fluka)溶液中,但在24小时内没有观察到杀灭作用。为了测试lps毒性是否由脂蛋白污染物引起,我们将7条dpf斑马鱼暴露于合成脂肽pamcys ser-(lys),(alx-165-066,axxora)的溶液中,这种合成脂肽是已知的免疫佐剂(erhard等人,2000),高达500μg/ml,并且在24小时内也没有观察到这些处理的杀灭作用。为了产生去磷酸化的脂多糖,将脂多糖与从牛肠粘膜(alpi12g,biozyme实验室)纯化的0.148u/μl ciap在37℃孵育4h,然后在80℃孵育10min以破坏ciap活性。模拟处理过的lps是在相同条件下孵育而不添加ciap的lps。为了抑制iap,除非另有说明,否则在试验期间,幼虫在10 mm l-phen溶液中孵育,从5 dpf开始。在l-phen处理的仔鱼中观察到一些残余iap活性,但是较高剂量的化合物不易溶解,似乎对鱼有毒。
碱性磷酸酶-AP活性如前所述被量化(Bates等人,2006)。简单地说,从10个幼虫或从中取出肠子的尸体上分离出的肠子被汇集、称重、均质并在对硝基苯基磷酸酯液体基质系统(sigma)中培养30分钟,在405nm处测量吸光度。
吗啉注射液
剪接阻断吗啉(mos)是从基因工具(corvalis,or)中获得的,除了myd88e2i2,这是lalita ramakrishnan博士(华盛顿大学)慷慨的礼物。所有的MOs 在一个细胞期以指定的最终量注入胚胎:IAPe2i2 (3 pmoles), TRlv1/TRlv2 (1.2 pmoles and 6 pmoles, respectively), MyD88e2i2 (25 pmoles), galTe2i2 (5.9 pmoles). MO oligo sequences are as follows: IAPe2i2: 5′-TGTAAAGTCGTCTTCATCACTCACC-3′, MyD88 e2i2: 5′- GTTAAACACTGACCCTGTGGATCAT-3′,TRlv1:5′- TACGTCCTTGTGCATTGCTGGCATC-3′,TRlv2:5′- CTGCATTGTGACTTACTTATCGCAC-3′.galTe2i2:5′ AAATCATTATGCACTCACCTGATGG-3′.
通过RT-PCR分析来自注入的幼虫的cDNA,使用设计成跨剪接位点的特异性引物观察到剪接阻断。 引物序列如下:IAPe1F: 5′-TCAGAGGCTCGGGATGTGTTTG-3′, IAPe5R:5′-GACTTTCCTTGTGCTTTGGCG-3′;MyD88elF:5′- TCTTGACGGACTGGGAAACTCG-3′,MyD88e5R:5′- GATTTGTAGACGACAGGGATTAGCC-3′;TR1F:5′- GCATGGATCCATATCAGGACTTGGTGGA-3′,TR1R:5′。 myd88-MO显示接近完全的剪接阻断,而tnfr1-MO和iap-MO在8 dpf时部分阻断了目标转录物的剪接(图S1)TCGAGAATTCTTACGAAACGCTTGTGTT-3′.
半定量RT-PCR分析
收集20只对照动物或用150μg/ ml LPS处理2小时的20只动物的解剖肠或剩余动物尸体,并通过匀浆并用Trizol试剂(Invitrogen)提取来收集RNA。 使用不含Turbo DNA的试剂盒(Ambion)进一步纯化RNA,以污染基因组DNA。 按照制造商的说明,将RNA用作模板,用Superscript III逆转录酶和随机引物(Invitrogen)生成cDNA。 随后通过PCR进行cDNA扩增25个循环,每个循环包括在94°变性15s,在59°退火30s引物和在72°延伸1分钟。 使用Taq DNA聚合酶(Roche)和20 pmol基因特异性引物对200ng cDNA进行测定。引物序列如下:IAPF: 5′-ATGGGAGTGTCCACGGTTTCAG-3′IAPR:5′-CGATGCCAACAGACTTTCCTTG-3′,ALPF:5′-GAAGGTCGTACAACTGCTTATCC-3′,ALPR:5′-
GATTCCCACTGATTTGCCTGC-3′,EF1AF:5′-CGTCTGCCACTTCAGCATGTG-3′,EF1AR:5′ACTTGCAGGCGATGTGAGCAG-3′.
Assays were performed using a TProfessional thermocycler (Biometra).
SYBR-Green实时定量(q)RT-PCR分析
从8dpf的GF,CV或MO注射的幼虫中收获RNA,并如上所述产生cDNA。 在25μl反应中用对应于600 ng总RNA的cDNA和300nM基因特异性或对照引物进行qRT-PCR分析。 使用Primer Express 2.0软件(Applied Biosystems)设计基因特异性引物。Primer sequences are as follows; IAP151: 5′-GCCCTCACACTGCCTCTCA-3′, IAP233: 5′GAAACCGTGGACACTCCCATT-3′, TNF1F: 5′-TCCTCAGACCACGGAAAAGTG-3′,
TNF1R: 5′-CAACCCATTTCAGCGATTGTC-3′, TNF2F: 5′-
GCTGGATCTTCAAAGTCGGGTGTA-3′, TNF2R: 5′-
TGTGAGTCTCAGCACACTTCCATC-3′, EF1AF: 5′-
CGTCTGCCACTTCAGCATGTG-3′, EF1AR: 5′-ACTTGCAGGCGATGTGAGCAG-3′.
使用ABI Prism 7900HT序列检测系统(Applied Biosystems)一式三份进行测定。 将数据标准化至EF1A (ΔΔ Ct analysis, as described in the ABI User Bulletin #2, http://docs.appliedbiosystems.com/pebiodocs/04303859.pdf).
组织学
除非另有说明,否则将斑马鱼幼虫在4%多聚甲醛中固定过夜,包埋在石蜡中,然后切成7μm厚的切片并将其安装在载玻片上。 样品在带有Nomarski和荧光光学镜的尼康TE2000倒置显微镜上成像。 使用CoolSNAP相机(Photometrics)或QImage Micropublisher相机(QImaging Corp)获得数字图像。 使用Metamorph收集并分析图像,并在Adobe Photoshop中进行处理。 对苏木精和曙红(H&E)染色的7μm横切面进行了与LPS治疗相关的组织病理学分析。
原位杂交--将5 dpf幼虫在4%PFA中静置过夜,并在1XPBST中洗涤。 将整个山体幼虫平衡到HYB +缓冲液中(Westerfield,1993),并在65°C下预杂交4h。 根据Boehringer的说明书(目录号1175025)制备RNA探针,并将HYB +中的100 ng RNA探针在65°C加热60分钟。 幼虫与RNA探针杂交36h。 通过将幼虫在2XSSC中的70%的50%甲酰胺中浸泡30分钟,然后在70°C的2XSSC的溶液中漂洗30分钟,并在70°C的0.2XSSC的溶液中漂洗2次,以除去探针。 根据标准方案(Westerfield,1993)检测探针,并如前所述将幼虫切成薄片进行成像。
髓过氧化物酶--将幼虫在4%PFA中静置过夜,并在1XPBS中洗涤。 用髓过氧化物酶试剂盒(Sigma)对整个幼虫进行染色,以对中性粒细胞进行组织化学鉴定。 Mpo活性已被用作斑马鱼嗜中性粒细胞的标志物,尽管在嗜酸性粒细胞和红细胞中也观察到弱染色(Lieschke等,2001),因此要注意不要过度显影Mpo染色。 染色后,将幼虫用0.1%Tween的1XPBS洗涤,包埋在石蜡中,将7μm的横切面固定在载玻片上。 定量分析肠上皮中Mpo染色强的细胞,该区域位于距肛门140微米的肛门连续20个连续切片中。
微生物群计量和分析
为了比较myd88-MO和WT同科的微生物群,将这些胚胎放在底部为网眼的聚碳酸酯圆柱体中,并在共享的微生物水生环境中饲养在同一罐中。在8 dpf时,将动物用三卡因甲磺酸盐(MS222,Sigma)安乐死,并在无菌水中漂洗3次。将分别注入10 WT或myd88-MO的幼虫置于100μl无菌水中,匀浆,稀释并在胰蛋白酶大豆琼脂上培养以计数CFU并检查菌落形态。为了估计斑马鱼幼虫肠道中的细菌浓度,据此我们可以推断出LPS的浓度,我们测量了从已知细胞数(斑马鱼微生物群的一个主要成员)维罗纳氏菌生物变种的已知细胞中扩增出的16S rRNA基因的平均数量。大约4份/ CFU。根据我们之前对每条斑马鱼扩增的16S rRNA拷贝的测量结果(Bates等,2006),我们计算出每8 dpf幼虫的细菌载量约为4×105。如果将液体倒入幼虫的肠道,我们估计该器官的体积约为1至4 nl。
统计分析—重复进行AP活性测定,每次治疗至少进行两次试验,并使用两个样本的t检验对数据进行分析,并假设Excel中存在不相等的方差(Microsoft Office)。 存活曲线至少进行两次,每次处理总共合计至少30条鱼。 使用GraphPad Prism(Kaplan-Meier分析,GraphPad软件,http://www.graphpad.com)对存活曲线的数据作图和分析。 还使用GraphPad Prism(使用一个分组变量进行单向ANOVA的散点图)对中性粒细胞计数进行图形化和分析,并假设Excel中的方差不相等,使用两样本t检验进行中性粒细胞计数分析。
补充材料
有关补充材料,请参见PubMed Central上的Web版本。
致谢
We thank Rose Gaudreau and the staff of the University of Oregon Zebrafish Facility for fish husbandry, Poh Kheng
Loi for histology services, Mimi Shirasu-Hiza for assistance with statistical analysis, Tamara Pozos and Lalita Ramakrishnan for the gift of the myd88-MO, Hilary Clay for sharing unpublished information on the tnfr1-MO, members of the Guillemin lab for insightful discussions, and Sarah Cheesman, Hilary Clay, Tory Herman, Robin Lesley and Lalita Ramakrishnan for critical reading of the manuscript. This research was supported by NIH grants R21 DK067065-01 and R01 DK075549-01 and a Burroughs Wellcome Fund Career Award in the Biomedical Sciences (to K.G.). NIH grant HD22486 provided support for the Oregon Zebrafish Facility.
参考资料
Alpers DH, Zhang Y, Ahnen DJ. Synthesis and parallel secretion of rat intestinal alkaline phosphatase and a surfactant-like particle protein. The American journal of physiology 1995;268:E1205–1214. [PubMed: 7611397]
Bates JM, Mittge E, Kuhlman J, Baden KN, Cheesman SE, Guillemin K. Distinct signals from the microbiota promote different aspects of zebrafish gut differentiation. Developmental biology 2006;297:374–386. [PubMed: 16781702]
Bennett CM, Kanki JP, Rhodes J, Liu TX, Paw BH, Kieran MW, Langenau DM, Delahaye-Brown A, Zon LI, Fleming MD, et al. Myelopoiesis in the zebrafish, Danio rerio. Blood 2001;98:643–651. [PubMed: 11468162]
Berczi I, Bertok L, Bereznai T. Comparative studies on the toxicity of Escherichia coli lipopolysaccharide endotoxin in various animal species. Canadian journal of microbiology 1966;12:1070–1071. [PubMed: 5339644]
Beumer C, Wulferink M, Raaben W, Fiechter D, Brands R, Seinen W. Calf intestinal alkaline phosphatase, a novel therapeutic drug for lipopolysaccharide (LPS)-mediated diseases, attenuates LPS toxicity in mice and piglets. The Journal of pharmacology and experimental therapeutics 2003;307:737–744. [PubMed: 12970380]
Beutler B, Milsark IW, Cerami AC. Passive immunization against cachectin/tumor necrosis factor protects mice from lethal effect of endotoxin. Science 1985;229:869–871. [PubMed: 3895437]
Beutler B, Rietschel ET. Innate immune sensing and its roots: the story of endotoxin. Nature reviews 2003;3:169–176.
Cario E, Podolsky DK. Intestinal epithelial TOLLerance versus inTOLLerance of commensals.
Molecular immunology 2005;42:887–893. [PubMed: 15829278]
Cheesman SE, Guillemin K. We know you are in there: Conversing with the indigenous gut microbiota.
Research in microbiology 2007;158:2–9. [PubMed: 17223317]
Eckburg PB, Relman DA. The role of microbes in Crohn's disease. Clin Infect Dis 2007;44:256–262.
[PubMed: 17173227]
Erhard MH, Schmidt P, Zinsmeister P, Hofmann A, Munster U, Kaspers B, Wiesmuller KH, Bessler WG, Stangassinger M. Adjuvant effects of various lipopeptides and interferon-gamma on the humoral immune response of chickens. Poultry science 2000;79:1264–1270.
Feulner JA, Lu M, Shelton JM, Zhang M, Richardson JA, Munford RS. Identification of acyloxyacyl hydrolase, a lipopolysaccharide-detoxifying enzyme, in the murine urinary tract. Infection and
immunity 2004;72:3171–3178. [PubMed: 15155618]
Fishman WH, Green S, Inglis NI. L-phenylalanine: an organ specific, stereospecific inhibitor of human intestinal alkaline phosphatase. Nature 1963;198:685–686. [PubMed: 13945318]
Foreman JE, Blizard DA, Gerhard G, Mack HA, Lang DH, Van Nimwegen KL, Vogler GP, Stout JT, Shihabi ZK, Griffith JW, et al. Serum alkaline phosphatase activity is regulated by a chromosomal region containing the alkaline phosphatase 2 gene (Akp2) in C57BL/6J and DBA/2J mice. Physiological genomics 2005;23:295–303. [PubMed: 16159911]
Freudenberg MA, Meier-Dieter U, Staehelin T, Galanos C. Analysis of LPS released from Salmonella abortus equi in human serum. Microb Pathog 1991;10:93–104. [PubMed: 1716342]
Henning SJ. Ontogeny of enzymes in the small intestine. Annual review of physiology 1985;47:231– 245.
Hirschfeld M, Ma Y, Weis JH, Vogel SN, Weis JJ. Cutting edge: repurification of lipopolysaccharide eliminates signaling through both human and murine toll-like receptor 2. J Immunol 2000;165:618– 622. [PubMed: 10878331]
Iiyama R, Kanai T, Uraushihara K, Ishikura T, Makita S, Totsuka T, Yamazaki M, Nakamura T, Miyata T, Yoshida H, et al. Normal development of the gut-associated lymphoid tissue except Peyer's patch in MyD88-deficient mice. Scandinavian journal of immunology 2003;58:620–627. [PubMed: 14636418]
Inoue K, Takano H, Shimada A, Yanagisawa R, Sakurai M, Yoshino S, Sato H, Yoshikawa T. Urinary trypsin inhibitor protects against systemic inflammation induced by lipopolysaccharide. Molecular
pharmacology 2005;67:673–680. [PubMed: 15576631]
Ismail AS, Hooper LV. Epithelial cells and their neighbors. IV. Bacterial contributions to intestinal epithelial barrier integrity. American journal of physiology 2005;289:G779–784. [PubMed: 16227525]
Jault C, Pichon L, Chluba J. Toll-like receptor gene family and TIR-domain adapters in Danio rerio.
Molecular immunology 2004;40:759–771. [PubMed: 14687933]
Kasper, DL.; Harrison, TR. Harrison's principles of internal medicine. Vol. 16. New York: McGraw-Hill Medical Pub. Division; 2005.
Kawai T, Adachi O, Ogawa T, Takeda K, Akira S. Unresponsiveness of MyD88-deficient mice to endotoxin. Immunity 1999;11:115–122. [PubMed: 10435584]
Koyama I, Matsunaga T, Harada T, Hokari S, Komoda T. Alkaline phosphatases reduce toxicity of lipopolysaccharides in vivo and in vitro through dephosphorylation. Clinical biochemistry
2002;35:455–461. [PubMed: 12413606]
Le Du MH, Millan JL. Structural evidence of functional divergence in human alkaline phosphatases. The
Journal of biological chemistry 2002;277:49808–49814. [PubMed: 12372831]
Li-Chan E, Nakai S. Enzymic dephosphorylation of bovine casein to improve acid clotting properties and digestibility for infant formula. The Journal of dairy research 1989;56:381–390. [PubMed: 2760303]
Lieschke GJ, Oates AC, Crowhurst MO, Ward AC, Layton JE. Morphologic and functional characterization of granulocytes and macrophages in embryonic and adult zebrafish. Blood
2001;98:3087–3096. [PubMed: 11698295]
Lu M, Zhang M, Takashima A, Weiss J, Apicella MA, Li XH, Yuan D, Munford RS. Lipopolysaccharide deacylation by an endogenous lipase controls innate antibody responses to Gram-negative bacteria. Nature immunology 2005;6:989–994. [PubMed: 16155573]
Macpherson AJ, Geuking MB, McCoy KD. Immune responses that adapt the intestinal mucosa to commensal intestinal bacteria. Immunology 2005;115:153–162. [PubMed: 15885120]
Mathias JR, Perrin BJ, Liu TX, Kanki J, Look AT, Huttenlocher A. Resolution of inflammation by retrograde chemotaxis of neutrophils in transgenic zebrafish. J Leukoc Biol. 2006
Meijer AH, Gabby Krens SF, Medina Rodriguez IA, He S, Bitter W, Ewa Snaar-Jagalska B, Spaink HP. Expression analysis of the Toll-like receptor and TIR domain adaptor families of zebrafish. Molecular immunology 2004;40:773–783. [PubMed: 14687934]
Millán, JL. Mammalian alkaline phosphatases: from biology to applications in medicine and biotechnology. Weinheim: Chichester, Wiley-VCH; 2006.
Miller SI, Ernst RK, Bader MW. LPS, TLR4 and infectious disease diversity. Nat Rev Microbiol 2005;3:36–46. [PubMed: 15608698]
Munford RS. Detoxifying endotoxin: time, place and person. Journal of endotoxin research 2005;11:69– 84. [PubMed: 15949133]
Munford RS, Varley AW. Shield as signal: lipopolysaccharides and the evolution of immunity to gramnegative bacteria. PLoS Pathog 2006;2:e67. [PubMed: 16846256]
Nakano T, Inoue I, Koyama I, Kanazawa K, Nakamura K, Narisawa S, Tanaka K, Akita M, Masuyama T, Seo M, et al. Disruption of the murine intestinal alkaline phosphatase gene Akp3 impairs lipid transcytosis and induces visceral fat accumulation and hepatic steatosis. American journal of
physiology 2007;292:G1439–1449. [PubMed: 17332477]
Narisawa S, Huang L, Iwasaki A, Hasegawa H, Alpers DH, Millan JL. Accelerated fat absorption in intestinal alkaline phosphatase knockout mice. Molecular and cellular biology 2003;23:7525–7530. [PubMed: 14560000]
Pasparakis M, Alexopoulou L, Episkopou V, Kollias G. Immune and inflammatory responses in TNF alpha-deficient mice: a critical requirement for TNF alpha in the formation of primary B cell follicles, follicular dendritic cell networks and germinal centers, and in the maturation of the humoral immune response. The Journal of experimental medicine 1996;184:1397–1411. [PubMed: 8879212]
Pfeffer K, Matsuyama T, Kundig TM, Wakeham A, Kishihara K, Shahinian A, Wiegmann K, Ohashi PS, Kronke M, Mak TW. Mice deficient for the 55 kd tumor necrosis factor receptor are resistant to endotoxic shock, yet succumb to L. monocytogenes infection. Cell 1993;73:457–467. [PubMed: 8387893]
Poltorak A, He X, Smirnova I, Liu MY, Van Huffel C, Du X, Birdwell D, Alejos E, Silva M, Galanos C, et al. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene. Science 1998;282:2085–2088. [PubMed: 9851930]
Pressley ME, Phelan PE 3rd, Witten PE, Mellon MT, Kim CH. Pathogenesis and inflammatory response to Edwardsiella tarda infection in the zebrafish. Developmental and comparative immunology
2005;29:501–513. [PubMed: 15752547]
Pull SL, Doherty JM, Mills JC, Gordon JI, Stappenbeck TS. Activated macrophages are an adaptive element of the colonic epithelial progenitor niche necessary for regenerative responses to injury. Proceedings of the National Academy of Sciences of the United States of America 2005;102:99– 104. [PubMed: 15615857]
Rawls JF, Mahowald MA, Ley RE, Gordon JI. Reciprocal gut microbiota transplants from zebrafish and mice to germ-free recipients reveal host habitat selection. Cell 2006;127:423–433. [PubMed: 17055441]
Rawls JF, Samuel BS, Gordon JI. Gnotobiotic zebrafish reveal evolutionarily conserved responses to the gut microbiota. Proceedings of the National Academy of Sciences of the United States of America
2004;101:4596–4601. [PubMed: 15070763]
Renshaw SA, Loynes CA, Trushell DM, Elworthy S, Ingham PW, Whyte MK. A transgenic zebrafish model of neutrophilic inflammation. Blood 2006;108:3976–3978. [PubMed: 16926288]
Rothe J, Lesslauer W, Lotscher H, Lang Y, Koebel P, Kontgen F, Althage A, Zinkernagel R, Steinmetz M, Bluethmann H. Mice lacking the tumour necrosis factor receptor 1 are resistant to TNF-mediated toxicity but highly susceptible to infection by Listeria monocytogenes. Nature 1993;364:798–802. [PubMed: 8395024]
Sartor RB. Mechanisms of disease: pathogenesis of Crohn's disease and ulcerative colitis. Nature clinical practice 2006;3:390–407.
Savage DC. Microbial ecology of the gastrointestinal tract. Annu Rev Microbiol 1977;31:107–133.
[PubMed: 334036]
Schromm AB, Brandenburg K, Loppnow H, Zahringer U, Rietschel ET, Carroll SF, Koch MH, Kusumoto S, Seydel U. The charge of endotoxin molecules influences their conformation and IL-6-inducing
capacity. J Immunol 1998;161:5464–5471. [PubMed: 9820522]
Stoltz DA, Ozer EA, Ng CJ, Yu JM, Reddy ST, Lusis AJ, Bourquard N, Parsek MR, Zabner J, Shih DM. Paraoxonase-2 deficiency enhances Pseudomonas aeruginosa quorum sensing in murine tracheal epithelia. Am J Physiol Lung Cell Mol Physiol 2007;292:L852–860. [PubMed: 17122353]
Tuin A, Huizinga-Van der Vlag A, van Loenen-Weemaes AM, Meijer DK, Poelstra K. On the role and fate of LPS-dephosphorylating activity in the rat liver. American journal of physiology
2006;290:G377–385. [PubMed: 16223948]
Van Amersfoort ES, Van Berkel TJ, Kuiper J. Receptors, mediators, and mechanisms involved in bacterial sepsis and septic shock. Clinical microbiology reviews 2003;16:379–414. [PubMed:
12857774] van der Sar AM, Stockhammer OW, van der Laan C, Spaink HP, Bitter W, Meijer AH. MyD88 innate immune function in a zebrafish embryo infection model. Infection and immunity 2006;74:2436–
2441. [PubMed: 16552074] van Veen SQ, van Vliet AK, Wulferink M, Brands R, Boermeester MA, van Gulik TM. Bovine intestinal alkaline phosphatase attenuates the inflammatory response in secondary peritonitis in mice. Infection
and immunity 2005;73:4309–4314. [PubMed: 15972524]
Wallace KN, Akhter S, Smith EM, Lorent K, Pack M. Intestinal growth and differentiation in zebrafish. Mech Dev 2005;122:157–173. [PubMed: 15652704]
Waymire KG, Mahuren JD, Jaje JM, Guilarte TR, Coburn SP, MacGregor GR. Mice lacking tissue nonspecific alkaline phosphatase die from seizures due to defective metabolism of vitamin B-6. Nature genetics 1995;11:45–51. [PubMed: 7550313]
Westerfield, M. The zebrafish book a guide for the laboratory use of zebrafish Danio (Brachydanio) rerio. Eugene, OR: Institute of Neuroscience University of Oregon; 1993.
Xuan D, Nicolau DP, Nightingale CH, Quintiliani R. Circulating tumor necrosis factor-alpha production during the progression of rat endotoxic sepsis. Chemotherapy 2001;47:194–202. [PubMed: 11306788]
Youngner JS. Bacterial lipopolysaccharide: oral route for interferon production in mice. Infection and immunity 1972;6:646–647. [PubMed: 4628903]
Zambonino Infante JL, Cahu CL. Ontogeny of the gastrointestinal tract of marine fish larvae. Comp
Biochem Physiol C Toxicol Pharmacol 2001;130:477–487. [PubMed: 11738635]

Figure 1.
Iap activity and iap transcription are regulated by LPS. In situ hybridization of iap transcript at 5 days post fertilization (dpf) in (A) a whole mount larva, and (B) a transverse section through the mid intestine (at the point indicated by the arrow in A). The iap specific purple stain is present in the intestinal epithelium (outlined with the dotted line in A) and is distinct from the black pigment cells above and below the digestive tract and the swim bladder (sb) in A. Scale bar in panel A = 100 μm, scale bar in panel B = 5 μm. (C) Semi-quantitative RT-PCR analysis showing iap and alp expression in dissected intestines (I) and carcasses from which intestines were removed (C) of 8 dpf larvae untreated or exposed to 50 μg/ml LPS for 24h. Levels of the housekeeping gene ef1α are shown as an amplification and loading control. (D) AP activity in the carcasses and intestines of 8 dpf untreated CV WT larvae, iap-MO injected larvae or larvae exposure to 10mM L-phen from 5 dpf. † Indicates values that differ significantly as compared to the CV levels of each group (carcass or intestine), P<0.01. (E) AP activity in 5 and 8 dpf intestines from larvae reared CV (solid bars) left untreated, exposed at 5 dpf to 30 μg/ml LPS, or injected at the 1 cell stage with myd88-MO or the control galT-MO, or larvae reared GF (striped bars) left untreated, exposed at 5 dpf to 3 μg/ml LPS, or mono-associated at 5 dpf with a Gram-negative Aeromonas species (G−) or a Gram-positive Streptococcus species (G+). † Indicates values that differ significantly from CV at 8dpf, * indicates values that differ significantly from GF at 8 dpf, P<0.01. For D and E, n=10 dissected intestines/treatment for each trial, with at least 2 trials per treatment. Error bars represent standard deviation. (F) iap transcript levels, measured by qRTPCR, were reduced in 8 dpf GF versus CV animals, and elevated in 8 dpf CV and GF animals exposed for 24h to 30 μg/ml LPS, but not in 8 dpf myd88-MO injected animals reared CV and exposed for 24h to 50 μg/ml LPS. Data are representative of two repeated trials, in which all samples were run in triplicate. Error bars indicate standard deviation. All animals were WT unless otherwise indicated.

Figure 2.
LPS toxicity in zebrafish. (A) Dose-dependent killing of wild-type animals exposed to LPS at
6 dpf. Analysis of survival curves show they are significantly different (Logrank test,P<0.0001). (B–C) H&E stained liver sections of untreated (UT) 8 dpf larvae or exposed to 100μg/ml LPS for 24h. (B) Hepatocytes in B show typical organization in cords (dashed line) with distinct nuclei (arrow). (C) LPS treatment resulted in disorganized tissue morphology, with cell boundaries that are difficult to distinguish and swollen hepatocyte nuclei (arrowhead), in contrast to the normal-sized nuclei of red blood cells (asterisks). Scale bar in panel B,C = 5 μm. (D) tnfa and tnfb transcript levels, assayed by qRTPCR, in WT and myd88-MO injected 7 dpf larvae exposed to 50 μg/ml LPS for 4 or 8 h, or WT exposed to 50 μ/ml CIAP treated LPS for 4 h. Data are representative of two repeated trials, in which all samples were run in triplicate. Error bars indicate standard deviation. (E–F) Mpo stained transverse sections of UT 8 dpf larvae or larvae exposed to 150 μg/ml LPS for 2h at the esophageal-intestinal junction (eij). Mpo-positive cells (dark brown) are present in the liver (1) of the LPS exposed animal in F. Scale bar in panel E,F = 10 μm. (G–H) Survival curves of myd88-MO or tnfr1-MO injected 7 dpf larvae exposed to 150 or 250 μg/ml LPS. Survival curves are significantly different (Logrank test, P<0.0001). n = at least 30 total animals for each sample treatment in at least 2 independent trials. All animals were exposed to LPS at 7 dpf except those in panel A, which all began treatment at 6 dpf to allow for 48 h time period to observe toxic effects of low doses of LPS (30–50 μg/ml) prior to termination of all experiments at 8 dpf.

Figure 3.
Iap functions to detoxify LPS. (A) LPS pretreated with CIAP was non-toxic to zebrafish at 250 μg/ml LPS, in contrast to mock treated LPS. Inhibition of IAP activity using (B) L-phen, or (C) with iap-MO or by rearing larvae GF, significantly increased susceptibility of larvae to
LPS killing. Survival curves are significantly different (except WT untreated and WT CIAPLPS in A, WT untreated, 10mM L-phen and WT 30 μg/ml LPS in B, and iap-MO 150 μg/ml
LPS and GF 150 μg/ml LPS in C, Logrank test, P < 0.0001). All animals were administered LPS at 7 dpf except in panel B, where animals exposed to 30 μg/ml LPS began treatment at 6 dpf. All animals were reared CV, unless otherwise indicated. n = at least 30 total animals for each sample group, in at least two independent trials.

Figure 4.
Iap functions to prevent intestinal neutrophil infiltration in response to the microbiota. Whole mount larvae at 6 dpf (A–D) and transverse sections through distal zebrafish intestines at 6 dpf (E–H) and 8 dpf (I–P) with Mpo positive neutrophils visualized in dark brown in the intestinal epithelium (arrowheads) and posterior cardinal vein (arrows); (black cells surrounding the intestinal epithelium are pigment cells.) The WT intestine contained low numbers of neutrophils at 6 (A) and 8 dpf (I), whereas GF intestines were devoid of all neutrophils (B,J). Neutrophil numbers increased significantly upon exposure to 150 μg/ml LPS for 2h (C) or with inhibition of endogenous Iap with iap-MO (D,E) or L-phen (O). Neutrophil infiltration was inhibited in myd88-MO (K) or tnfr1-MO injected larvae (L), even upon exposure to 150 μg/ ml LPS for 2h (M–N) or co-injection with iap-MO (F–G). In the absence of microbiota, Iap inhibition did not induce neutrophil influx (H,P). All animals were reared CV unless otherwise indicated. Scale bar in panel D (A–D) = 50 μm, scale bar in panel P (E–P) = 5 μm. (Q–R) Quantification of neutrophils per 140 μm of distal intestine, n = at least 13 animals per treatment; bar indicates average value for each group. † indicates values that differ significantly from WT, * indicates values differ significantly from WT LPS treated, P < 0.01. One-way analysis of variance (ANOVA) show treatments differ significantly, (Q) F = 99.24, P < 0.0001 (R) F = 142.7, P < 0.0001.

Figure 5.
A model of Iap function in the intestinal epithelium. Iap is induced by microbiota-associated LPS and dephosphorylates this LPS, thereby establishing a homeostatic negative feedback loop that reduces signaling through Tlrs and Tnf and prevents excessive intestinal inflammation.
