Evgeniya E. Burkova 1, Alina E. Grigor’eva 1, Dmitrii V. Bulgakov 2, Pavel S. Dmitrenok 3, Valentin V. Vlassov 1, Elena I. Ryabchikova 1 , Sergey E. Sedykh 1,† and Georgy A. Nevinsky 1,*,†
1 SB RAS Institute of Chemical Biology and Fundamental Medicine, 8 Lavrentiev Ave., 630090 Novosibirsk, Russia; jorochka24@mail.ru (E.E.B.), feabelit@mail.ru (A.E.G.); valentin.vlassov@niboch.nsc.ru (V.V.V.); lenryab@yandex.ru (E.I.R.); sirozha@gmail.com (S.E.S.)
2 Federal Scientific Center of the East Asia Terrestrial Biodiversity, Far Eastern Branch of Russian Academy of Sciences, 690022 Vladivostok, Russia; bulgakov-dv@mail.ru
3 G. B. Elyakov Pacific Institute of Bioorganic Chemistry FEB RAS, 159 100 let Vladivostoku Ave., 690022 Vladivostok, Russia; paveldmt@piboc.dvo.ru
* Correspondence: nevinsky@niboch.nsc.ru; Tel.: +7-383-363-51-26
† These authors contributed equally to this work.
摘要:外泌体是一种包含多钟RNA和不同蛋白质的纳米囊泡(30-100 nm)。其在细胞内通讯,免疫功能等方面很重要。不同来源(包括胎盘)的外泌体主要通过不同类型的离心和超速离心获得,据报道其中包含数十种至数千种不同的蛋白质。首先使用几次标准离心从四个胎盘(正常妊娠)中获得的外泌体制剂,然后再通过Sepharose 4B的凝胶过滤将其纯化。单个制剂会显示出不同的凝胶过滤曲线,展现出外来峰与杂质蛋白及其复合物的两个峰之间的好坏之分。通过电子显微镜观察到,凝胶过滤前的外泌体包含不同大小的囊泡,由铁蛋白形成的环状结构以及聚集的蛋白质及其复合物簇。通过220 nm滤膜和凝胶过滤后,外泌体通常显示出其外泌体的形态和大小(30–100 nm),并且不含可见的蛋白质混合物。蛋白质的胰蛋白酶解产物通过SDS-PAGE和2D电泳后,通过MS和MS / MS MALDI质谱进行外泌体蛋白质的鉴定,我们获得了意想不到的结果。优质的纯化外泌体仅包含11-13种不同的蛋白质:CD9,CD81,CD-63,血红蛋白亚基,白介素-1受体,膜联蛋白A1,膜联蛋白A2,膜联蛋白A5,胞质肌动蛋白,碱性磷酸酶,血清转移蛋白,以及可能是人血清白蛋白和免疫球蛋白。我们假设以前使用粗制制剂发现的可能的外泌体蛋白数量可能被过度高估了。我们的数据可能对研究纯外泌体的生物学功能很重要。
关键词:人体胎盘;外泌体提纯;蛋白质分离;蛋白质鉴定
1. 引入
人胎盘是连接母体和胎儿生物体的高度特定化的器官,胎盘功能障碍可能对两者都会带来灾难性后果。 胎盘的绒毛与合体滋养层细胞接壤,形成了分隔母婴血液循环的血胎盘屏障[1]。 胎盘可保护、滋养和调节胚胎的生长[2-4]。 妊娠和胎盘功能研究的进展可能有助于移植法的发展; 但这也需要对母亲和胎儿的生化特征进行详细研究。
外泌体是直径为30–100 纳米的囊泡,具有独特的分子组成,能够实现许多功能,包括细胞间通信[5,6]。 细胞之间的信号传递对于母胎系统尤为重要,在该系统中胎盘是提供两种生物之间相互作用并保持其个性的器官[1,2,4]。 胎儿和母亲之间的分子信号传递仍然是模糊的,并且尚未发现外泌体在此过程中的可能作用。
已知外泌体是通过向晚期内体的膜内陷形成的,这些内体在体内积累,随后从细胞中释放出来[5,6]。 根据现代分类,外泌体属于细胞外囊泡的类别,其还包括微囊泡和凋亡小体。 外泌体是从人类和哺乳动物的各种生物体液中分离出来的,包括牛奶[1,5-14]。
胎盘外泌体及其分子组成研究的相关性取决于胎盘中是否存在多种因素,包括生物活性RNA、DNA、蛋白质、肽、抗体和其他成分[1-4]。
外泌体研究的进行是通过使用多种方法从生物体液中分离出来制剂,其中包括离心沉淀、超速离心以及密度梯度超速离心[15-27]; 通过孔径为0.1–0.2μm的过滤器和其他方法进行超滤[25–29]。 应当注意的是,所有这些方法可以获得富含外泌体的制剂,而不是均质的纯外泌体制剂,因此会影响外泌体的分子组成。 实际上,每种外泌体分离的方法可能导致数据的高度可变,并且在不同出版物中,在外泌体中鉴定出的蛋白质数量变化范围甚至达数百倍[15-29]。
对78个已公开的外泌体数据库进行的萃取分析显示,从正常和癌细胞的培养液以及各种物种(包括人,小鼠,大鼠, 牛,苍蝇,酵母,甚至细菌[13]。 胎盘外泌体蛋白质组成的数据很少,在不同的研究中差异很大。 根据蛋白质分析方法的不同,在胎盘外泌体制剂中发现了数百甚至数千种蛋白质:349 [30]和1476蛋白[31]。
在人类合体滋养层微囊泡的蛋白质组学分析中,鉴定出超过400多种蛋白质[32]。 与健康孕妇相比,子痫前期中发现25种蛋白质(整合素,膜联蛋白和组蛋白)的表达差异。根据研究结果[1]科研假设可能存在来自不同来源的外泌体的一般和特定标记。
根据文献资料显示,不同来源的外泌体可能包含不同量的蛋白质。例如,树突状细胞外泌体的粗制品可以包含150-200多种不同的蛋白质[32-34]。 分析奶牛乳汁外泌体的蛋白质时,通过蔗糖梯度中的离心和超速离心分离[35] 甚至获得了更不可能的结果。最终是鉴定出2107种蛋白质,其中包括先前检测到的外泌体的所有主要蛋白质标记。牛乳外泌体蛋白中最代表的蛋白是乳脂球的膜蛋白:酪氨酸,黄嘌呤氧化酶,己二酸和乳糖苷[36]。
我们的经验表明,研究人员使用的用于分离外泌体的方法仅允许获得某种程度上富集了外泌体的制剂。生物流体包含蛋白质的超分子聚集体,当离心和超速离心时,它们会与外泌体共沉淀。此外,我们最近发现,人乳和胎盘中含有非常稳定的高分子量(〜1000 kDa)多蛋白复合物,其大小可与外泌体相媲美[37,38]。另外,一些蛋白质可以特异性或非特异性地结合到包埋在其膜中的外泌体或受体的表面。考虑到所有这些因素,我们认为外泌体中所含蛋白质的文献报道数量可能被过度高估了。在这方面,E.D斯维尔德洛夫值得一提,他认为在外泌体的情况下,他们内部分子成分的定量评估被错误估计,对此他形象的表达为“肯定会使Amedeo Avogadro哭泣” [39]。
最近,我们对马奶的外泌体进行了蛋白质组学分析[40]。 通过几种常规离心和超速离心获得的外泌体制剂不仅包含外泌体(40–100 nm),而且还包含许多越来越小的囊泡,以及杂质蛋白及其寡聚复合物。 使用凝胶过滤从稳定的高分子复合物和其他蛋白质中进一步纯化外泌体后,根据牛奶样品的不同,在牛奶成分中仅检测到7-8种的主要蛋白质[40]。 在外泌体出现第一个波峰之后,我们在第二个峰中发现了先前在牛和人乳外泌体制剂中发现的所有其他蛋白质,但分子量较低[40]。
[41]的目的是引起研究人员对外泌体制剂被污染的关注。目前被广泛采纳的方案是通过顺序离心从各种生物流体中分离外泌体制剂。所有制剂(超过200种)均包含通过免疫电子显微镜鉴定的结合至CD63或CD9抗体的外泌体。除了外泌体,所有制剂均包含低电子密度污染结构,该结构没有内界膜,因此不是外泌体(“非囊泡”)。两种主要类型的“非囊泡”需要引起注意:大小为20–40 nm占大小为40–100 nm的外泌体所有结构的10–40%。 “非囊泡”的形态使得它们被分类为中密度脂蛋白和低密度脂蛋白(20–40 nm)以及极低密度脂蛋白(40–100 nm)。因此,未经额外纯化的外泌体制剂可能含有性质非常不同的杂质,包括蛋白质和核酸。在大多数已发表的文章中,都对此类粗制的外泌体制剂进行了精确的蛋白质和核酸含量分析。
在这项研究中,我们使用标准的离心方法分析了从四个人胎盘中获得的外泌体蛋白,并通过凝胶过滤对其进行了纯化。 凝胶过滤可以从外泌体制剂中分离出大量蛋白质,这些外泌体制剂在不同的离心过程中会与外泌体共沉淀。 使用一维和二维电泳分离纯化纯化的外泌体的蛋白质,并使用MALDI MS和MS / MS光谱法对它们的胰蛋白酶解产物进行鉴定,就像在马奶中一样[40]。 我们获得了意想不到的结果:从胎盘中分离出的外泌体仅包含10-12种主要蛋白质。
2. 结论
根据[14–28,34–36]进行离心和超速离心并进行一些更改[40],首先,我们从四个人类胎盘中获得了富含外泌体的制剂。
为了进一步纯化外泌体制剂,将获得的制剂通过过滤器(0.1–0.22μm),然后在分离出60–20,000
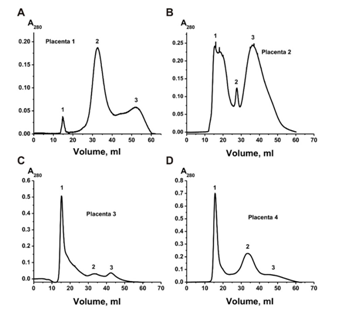
kDa蛋白质的Sepharose 4B上进行凝胶过滤。 图1显示了四种不同的凝胶过滤曲线-外泌体在第一个峰洗脱,与杂质蛋白的两个峰分离。 四种外泌体制剂显示出不同的吸收率(A280),分别对应于外泌体的第一个峰和在不同离心过程中与它们共沉淀的两个杂质蛋白峰。
图1. 四种胎盘粗制外泌体制剂的四种不同谱图(先前通过数种不同的离心方法部分纯化,并通过 0.1μm滤膜过滤)在Fusharose 4B色谱柱上通过FPLC凝胶过滤进行纯化:(-),在280 nm(A280) 的吸光度。 外泌体的四种不同制备方法(A-D)。 凝胶过滤后,可以看到三个峰(1-3)。
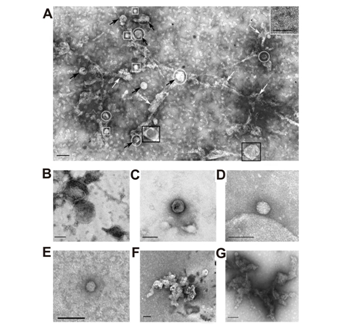
在每个阶段的分离后,都使用了透射电子显微镜对外泌体制剂进行了分析。过滤前,所有制剂均包含直径小于100 nm的囊泡(黑色箭头)和直径大于100 nm的囊泡(黑色正方形),微粒(白色正方形)和无定形蛋白质聚集体(白色箭头)(图2A) 。图2还显示了富含外泌体的制剂的几种单独的特定结构:尺寸大于100 nm的大膜结构(B);直径小于100
nm的囊泡(C),尺寸不超过40 nm的无限制膜的微粒(直径为40–60 nm的种群II的微粒)(G)和尺寸小于40 nm(种群I的直径为20–40 nm的微粒)(D);聚集蛋白簇(E和G);铁蛋白环结构(10-14 nm)(插图A)。
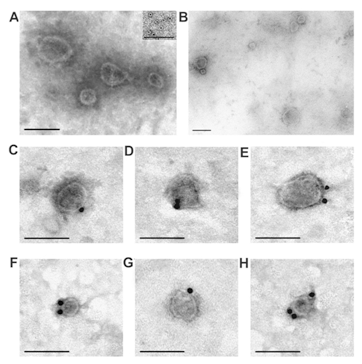
通过凝胶过滤后,制剂包含各种大小的外泌体(30–100 nm),以及一些环状超分子形式(10–14 nm),但不含可见的无定形蛋白质物质(图3A,B)。通常,外泌体必须包含CD81和/或CD63 [5]。我们使用直接方法;通过凝胶过滤纯化的囊泡含有CD81和CD63。这些标记蛋白用针对CD81(图3C,D)和CD63(图3E–G)的抗体标记。因此,就其表面上四跨膜蛋白CD81和CD63的形态,大小和含量而言,纯化的胎盘囊泡符合典型外泌体的要求。
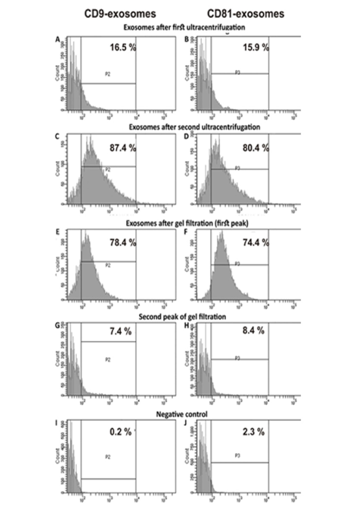
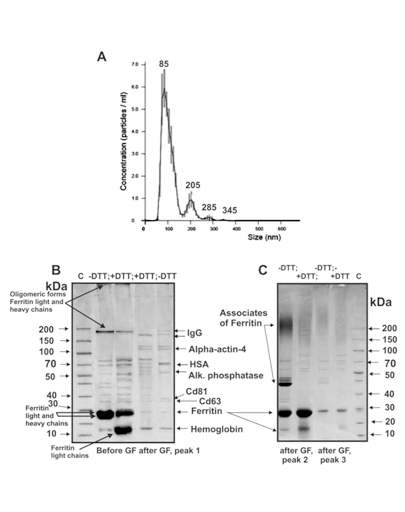
在第一次,第二次超速离心和凝胶过滤后,使用流式细胞仪评估含有CD9和CD81的囊泡的相对量(图4)。凝胶过滤后的胎盘囊泡包含78.4±4.0%的CD9囊泡和74.4±4.0%的CD81颗粒(图4E,F)。凝胶过滤后的颗粒产率较高,约为90%–93%。因此,显而易见的是,凝胶过滤不会导致外泌体主要部分的损失。凝胶过滤后,不同大小的囊泡含量使用纳氏磁道分析法进行了评估(图5A)。通过纳米径分析发现的估计颗粒的流体动力学尺寸的囊泡的平均大小(并且无法区分单个颗粒及其缔合体)明显高于电子显微镜的情况。然而,囊泡主要部分的平均大小(84±5 nm; 86%±3%)与电子显微镜数据非常一致,有关电子制剂中主要存在40至100 nm大小的颗粒。
图3.透射电子显微镜,负对比度。 通过具有100 nm孔的过滤器过滤后进行胎盘外泌体的制备,然 后进行凝胶过滤(A,B)。 囊泡(A)和铁蛋白环结构(10-14 nm;插图A中的插图)不存在可见 的蛋白质簇。 通过凝胶过滤纯化的外泌体,用金纳米颗粒与针对四跨膜蛋白CD81(C,D和E)和对CD63(F,G和H)的单克隆抗体的缀合物标记。标尺线的长度为100 nm。
使用SDS-PAGE,我们分析了通过凝胶过滤获得的有三个峰的蛋白质。图5B显示了对应于第一个外泌体制剂的exo-1的SDS-PAGE的典型结果。外泌体的波峰与蛋白质杂质的第二个和第三个波峰完全分开。电子显微镜检查显示,在凝胶过滤之前和之后,外泌体制剂中铁蛋白(10-14 nm)会形成环超分子结构(图3A)。根据凝胶过滤前SDS-PAGE的结果,铁蛋白的轻链和重链是exo-1(图5C)和其他三种制剂的主要蛋白质。
在没有二硫苏糖醇(DTT)的情况下,一部分铁蛋白对应于MMs〜23–25
kDa,其寡聚形式为〜180 kDa的单体以及凝胶中未包含的铁蛋白-蛋白质复合物(图5C,道– DTT;凝胶过滤之前)。用DTT处理exo-1会导致寡聚形式部分遭受破坏,并使对应于铁蛋白轻链带中的蛋白质增加(图5C,+ DTT)。用DTT处理外泌体制剂之前的峰2和3主要包含寡聚形式的铁蛋白(图5C,-DTT)。用DTT处理后,exo-1含有较少的铁蛋白寡聚形式(图5C,+ DTT)。凝胶过滤导致exo-1制剂中铁蛋白几乎完全消失(图5B,-DTT)。通过凝胶过滤前后三种其他外泌体制剂获得了类似的结果。
图5.使用Nanosight NS300设备在制备凝胶过滤后对外泌体大小进行纳米颗粒追踪分析(A)。通 过过滤0.1μm,但在FPLC凝胶过滤(B;两个第一泳道:–DTT和+ DTT)过滤后,通过过滤后的 exosome制剂exo-1的内在蛋白质的SDS-PAGE分析 (B;两个第二车道:–DTT和+ DTT)。对 exo-1制剂(C;–DTT和+ DTT泳道)进行凝胶过滤后,分析对应于峰2和峰3(图1A)的杂质 蛋白质。泳道C对应于具有已知MM(B和C)的对照蛋白。使用MALDI质量MS和对应于SDS-PA
后蛋白质条带的蛋白质水解产物的MS / MS数据进行蛋白质鉴定;鉴定的蛋白质列在B和C中。
exo-2制剂的凝胶过滤稍弱的分离了外泌体的峰与离心过程中共沉淀的蛋白质峰(图1B),并且所得外泌体的制剂即使在对应于第一个峰的第一个峰处也含有许多不同形式的铁蛋白外泌体。
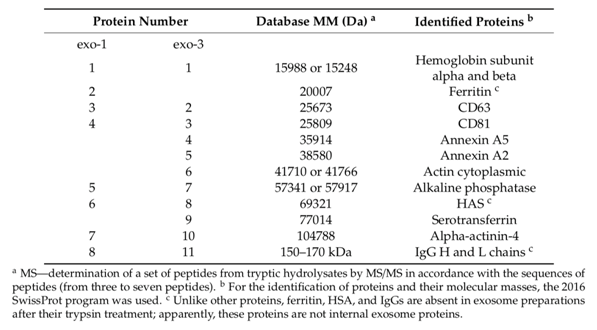
在通过凝胶过滤分离出exo-1第一峰蛋白质的一维SDS-PAGE后,使用MALDI质谱法鉴定了八种主要蛋白质,胰蛋白酶蛋白水解物的MS / MS对应于蛋白质谱带:血红蛋白,铁蛋白(单体)和低聚物),CD63,CD81,碱性磷酸酶,人血清白蛋白(HSA),α-肌动蛋白4和IgG(图5B,-DTT,峰1,表1)。
在对exo-2的第一个峰进行类似的SDS-PAGE后,鉴定出11种蛋白:铁蛋白(单体和寡聚物),血红蛋白,CD81,CD63,膜联蛋白,细胞质肌动蛋白,碱性磷酸酶,HSA,血清转铁蛋白,α-肌动蛋白-4和 IgG。
针对exo-3,仅鉴定出11种蛋白质(表1);
它另外包含两个膜联蛋白:膜联蛋白5和膜联蛋白2(图6A)。 有趣的是,在exo-3的情况下,铁蛋白几乎不存在(图6A,磁道1)。 因此,通过电子显微镜在外泌体制剂中鉴定出的环状铁蛋白超分子结构(图3),原则上可以通过凝胶过滤去除,因此应视为在不同离心过程中与外泌体共沉淀的蛋白质。
表1.通过MS和MS
/ MS方法鉴定的蛋白质的数据,这些蛋白质对应于exo-1(图 5B)和exo-3 (图6A)的凝胶过滤后的第一个峰,以及随后通过SDS-PAGE分离的峰。
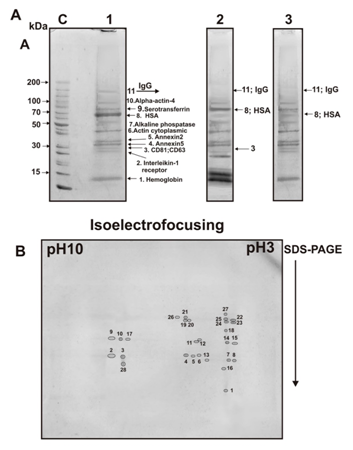
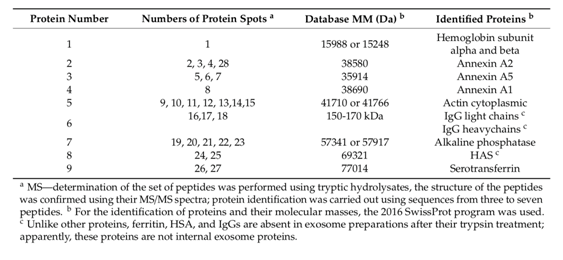
紧接着,我们分析了使用2D电泳通过exo-3制剂的凝胶过滤获得的第一个峰的蛋白质(图1C),并鉴定了28个染色斑点(图6B),仅对应于9种不同的蛋白质及其同工型(表2)。有趣的是,只有一个斑点对应于血红蛋白和膜联蛋白A1的亚基。其余斑点对应于蛋白质的不同同工型(蛋白质斑点数量):膜联蛋白A2(4),膜联蛋白A5(3),胞质肌动蛋白(7),碱性磷酸酶(5),HSA(2)和血清转铁蛋白(2)。确定了三个蛋白斑点为免疫球蛋白的轻链和重链(表2)。因此,二维电泳只能鉴定9种蛋白质。同时,只有在一维电泳后才能鉴定出三种次要蛋白质CD81,CD63和alpha-actin-4;二维电泳可用于另外鉴定膜联蛋白A1(表2)。
通过SDS-PAGE分析exo-4第一个峰的蛋白质时,鉴定出11种蛋白质:铁蛋白,血红蛋白,CD81,CD63,膜联蛋白2,膜联蛋白5,胞质肌动蛋白,碱性磷酸酶,HSA,α-肌动蛋白4和IgG。
因此,外泌体的四个样本包含几种常见的蛋白质(鉴定出该蛋白质的制剂数量):铁蛋白(3),血红蛋白(4),CD81(4),CD63(4),各种膜联蛋白(4),胞质肌动蛋白(4),α-肌动蛋白4(3),碱性磷酸酶(4),HSA(4),血清转铁蛋白(4)和IgG(4)。补充表S1列出了四种外泌体制剂经过电泳分析(1D和2D)后使用MS和MS / MS鉴定所有蛋白质的数据。
图6. exo-3制剂的蛋白质在其过滤之前(泳道1)和用二硫苏糖醇处理(泳道2)以及经过胰蛋白酶 处理后(泳道3)(A)的凝胶进行SDS-PAGE分析。分子量标记(泳道C)。DTT处理后,HSA的分子 量由于二硫键的减少而增加(泳道2),而IgG对应的条带由于形成了游离的重链和轻链而消失。用 胰蛋白酶处理可导致HSA,IgG, CD63和CD81水解,但不会水解该制剂的其他蛋白质(泳道3, A)。通过凝胶过滤分离exo-3蛋白的二维凝胶电泳(B)。首先使用等电聚焦分离蛋白质,然后通 过SDS-PAGE分离蛋白质。用考马斯R-250染色的28个蛋白斑点对应于:血红蛋白亚基(斑点1),膜 联蛋白A2(2、3、4和28),膜联蛋白A5(5、6和7),膜联蛋白A1(8) ,免疫球蛋白的胞质肌动 蛋白(9、10、11、12、13、14和15),轻链(16)和重链(17和18),碱性磷酸酶(19、20、 21、22和23), HSA(24和25)和血清转铁蛋白(26,27)。
表2.通过MS和MS / MS方法鉴定的蛋白质的数据,这些蛋白质对应于exo-3(图1C)和exo-3(图 6B)凝胶过滤后的第一个峰,以及随后通过2D电泳分离的峰。
3.讨论
首先,从四个胎盘获得粗囊泡制剂(区别在使用的不同的离心作用)。它们并不纯净含有杂质,并包含许多大小约30-300 nm的不同囊泡的结构,各种蛋白质及其大分子(图2)。通过过滤器(100 nm)过滤这些制剂,并通过凝胶过滤进行纯化,可去除某些类型的囊泡以及许多共沉淀的蛋白质及其复合物(图1和图3)。通过凝胶过滤分离的外泌体含有CD81和CD63(图3)。因此,从人胎盘中分离出来的囊泡在形态,大小(30-100 nm)以及其表面CD81和CD63四跨膜蛋白的含量方面相当于先前从各种来源获得的囊泡[5]。
根据文献,来自各种生物体液和组织的外泌体可能包含数十种至数千种不同的蛋白质。但是,大多数使用各种离心方法获得的外泌体制剂的研究[1,5–27]包含大量非常不同的杂质,包括不同的囊泡,无膜的结构(“非囊泡”),蛋白质及其相关物(图2)。)。此类制剂的凝胶过滤导致主要杂质的分离。通过凝胶过滤分离的胎盘外泌体的MALDI质谱分析仅鉴定出几种主要蛋白质。但是,在凝胶过滤后的第二个和第三个峰中检测到了大量不同的蛋白质(图1)。
使用二维电泳后,发现了28个蛋白质斑点对应9种不同的蛋白质及其同工型(表2)。总体而言,使用两种电泳分析方法,在四种外泌体制剂中鉴定出12种蛋白质:CD81,CD63,血红蛋白亚基,膜联蛋白A1,膜联蛋白A2,膜联蛋白A5,胞质肌动蛋白,α-肌动蛋白-4,碱性磷酸酶,血清转铁蛋白,HSA,免疫球蛋白(表1和2)。此外,使用流式细胞仪显示了CD9(图4)。
铁蛋白在使用凝胶过滤和蛋白水解酶处理外泌体后消失。用胰蛋白酶和胰凝乳蛋白酶处理外泌体制剂后,据SDS-PAGE数据显示,对应于HSA和免疫球蛋白的蛋白条带几乎完全消失。不能排除HSA和免疫球蛋白能与四跨膜蛋白形成相对稳定的复合物,或直接与外泌体表面相互作用。
随之而来的问题是为什么我们检测到的蛋白质比其他研究人员发现的要少得多[33,34]。 图1显示,与对应共沉淀蛋白的第二个和第三个凝胶过滤峰相比,外泌体峰在280 nm处吸收峰值相小于7%。 图2A显示,纯化不良的制剂不仅包含各种大小的囊泡,而且还包含许多蛋白质及其复合物。
先前发表的文章描述了从胎盘滋养层细胞获得的外泌体[34,35]。 因此,不能排除在正常妊娠期间胎盘细胞和培养的细胞可以分泌含有不同蛋白质组的外泌体。
从我们的分析来看,从各种来源分离出来的外泌体中直接包含的实际蛋白质数量(数十万种)可能会被过度高估。
根据文献数据所提供的,胎盘外泌体可能含有数十至数千种不同的蛋白质[30,31]。例如,在胎盘外泌体CD9、CD63、CD81 [30,31]、胎盘碱性磷酸酶[10]、促凋亡FasL1-4和TRAIL
[9]的许多蛋白质中,发现了调节性细胞因子TGFb [10]、合体素1和syncytin-2蛋白[42] 。然而在在雌性胎盘的外泌体制剂中,我们仅发现其中一些蛋白质:CD9,CD81,CD-63和碱性磷酸酶。由于在发表的论文[9,10,30,31,42]中仅通过各种类型的离心分离了外泌体,我们的数据无法与它们进行比较,还有一个悬而未决的问题:被发现的蛋白哪些是直接属于外泌体的?在这方面,我们应注意以下数据。通过三种不同方法(超速离心,高分辨率密度梯度分级分离和直接免疫亲和捕获)的顺序组合,从人结肠癌DKO-1中获得了高度纯化的外泌体制剂[43]。结果表明,这些外泌体制剂仅包含15种主要蛋白质:CD9,CD63,CD81,膜联蛋白A2,膜联蛋白V,TSG101,Syntenin 1,ALIX,14-3-3 zeta /δ,14-3-3 epsilon,HSC70, EEF1-A1,醛缩酶A,烯醇酶I和LADH。我们在胎盘外泌体中发现了这些蛋白质中的六个:CD9,CD81,CD-63,膜联蛋白A2,膜联蛋白A5。但是,来自不同器官和细胞的外泌体制剂中不同蛋白质的含量很可能差异很大。例如,来自几种不同马奶的超纯外泌体仅包含五个相同的主要蛋白质(CD9,CD81,CD63,β-乳球蛋白和乳黏附素),而肌动蛋白,酪氨酸,乳铁蛋白和黄嘌呤脱氢酶仅在某些他们[40]。在来自各种器官和细胞的外泌体的情况下,蛋白质组成的更大差异。
尽管现在还未发现我们在外泌体中鉴定出的主要蛋白的重大意义和功能,所有这些蛋白质在哺乳动物的机体中都起着重要的作用[44-48]。例如,膜联蛋白已显示出直接参与囊泡的形成以及胞吐和胞吞过程中囊泡的运输。
在本项研究中,我们分析了来自人胎盘的额外纯化外泌体的主要蛋白质发现它们包含相对少量的主要蛋白质。当然这些外泌体也可能包含一些其他微量蛋白质,是无法使用SDS-PAGE和MALDI质谱检测到的。但从我们的实验结果出发,从外泌体中鉴定出成百上千种蛋白质的结论是被过度高估了。另外,在外泌体中发现的蛋白质的多样性提出了与这些囊泡共沉淀的蛋白质以及外泌体的可能固有的次要蛋白质在外泌体的生物学功能中是否具有重要作用的疑问。
4.材料和方法
4.1材料
Sepharose
4B的试剂和吸附剂来自Sigma(美国密苏里州圣路易斯)。 根据赫尔辛基伦理委员会的指导,采血方案符合当地人类伦理委员会的指导原则(2015年1月20日由俄罗斯新西伯利亚的新西伯利亚国立医科大学伦理委员会批准;机构伦理委员会专门批准了本研究)。
为了科学目的,所有母亲均签署提供胎盘的书面授权书。 产科医生/妇科医生为我们提供了来自正常妊娠母亲(20-32岁)的匿名胎盘样本,这些母亲没有自身免疫,风湿病,呼吸道,心血管,胃肠道,生殖或神经系统疾病的病史。 提供授权书和样本的女性均生育了健康的孩子。
4.2 胎盘提取物的制备
为防止血液凝结,每个新鲜的胎盘样本都被放置于2.0 L 1%柠檬酸钠溶液中。为清楚胎盘余血,使用几个注射器(40 mL),将与0.1%NaCl对应的1%柠檬酸钠溶液在压力下注入胎盘的血管,该注射器分别对应于所有大,中,小血管以及不同厚度的针头。然后,将新鲜的胎盘(〜400–500
g)切成小块,用缓冲液(20 mM Tris-HCl,pH 7.5,125 mM KCl,0.5 mM EDTA-NaOH,pH 7.5和0.5%钠)洗涤3次。柠檬酸盐)以清除残留的血液。接下来,将胎盘的压碎片在含有250 mM蔗糖,20 mM Tris-HCl(pH 7.5),125 mM KCl,10
mM MgCl2、0.5 mM EDTA(pH)的冷缓冲液(+4°C; 425 mL)中匀浆7,5)和0.5%的柠檬酸钠。胎盘匀浆以26,000x g离心30分钟(Beckman Coulter Avanti-J-301离心机,JA-30.50Ti转子,Brea,CA,美国),除去沉淀物。将上清液用H2O透析2 h,然后用TBS缓冲液(20 mM Tris-HCl,pH 7.5,0.15 M NaCl)透析12 h,然后将透析的上清液用于分离外泌体。
4.3 囊泡制剂的纯化和制签
胎盘提取物制剂从总胎盘中获得。
将上清液进行顺序离心:在10,000×g下于4℃离心40分钟,然后在16,500×g上离心20分钟(Beckman
Coulter Avanti-J-301离心机,JA-30.50 Ti转子),将上清液通过0.22微米过滤器。 将过滤的上清液以100,000×g超速离心2小时。 第一次离心后,将沉淀重悬于8 mL TBS中。 将重悬的沉淀物以100,000×g超速离心2小时(Beckman
L8-M离心机,SW-60转子(Brea,CA,美国)),将沉淀重悬,通过过滤器(0.1μm)过滤并用于进一步纯化 为了进一步纯化外泌体,使用琼脂糖凝胶4B在柱上进行凝胶过滤。
4.4 凝胶过滤纯化囊泡制剂
为了进一步纯化外泌体,如[38]所述,使用分子量为60–20,000
kDa的Sepharose 4B分离蛋白进行凝胶过滤。将浓缩的外泌体溶液(0.5 mL)用GE Akta Purifier色谱仪(Chicago,IL. USA)和同一缓冲液洗脱的馏分(1 mL)。 通过在280nm处的吸光度监测外泌体和蛋白质。 为了除去NaCl,将级分在4°C下用20 mM Tris-HCl(pH 7.5)透析14 h,然后用于不同类型的分析。所有实验均在无菌条件下进行。
4.5 外泌体的电子显微镜研究
将涂有聚醋酸甲基乙烯脂的铜栅格放在一滴外泌体制剂上1分钟,然后用滤纸收集多余的液体,然后将栅格与0.5%的乙酸铀酰溶液或2%的磷钨酸溶液对比。如[38]中所述,酸持续10-15 s。使用配备有Veleta数码相机(EM SIS,德国明斯特)的Jem1400(日本东京,Jeol)透射电子显微镜检查网格。为了鉴定外泌体的特异性标记,将囊泡与抗CD81和CD63的小鼠单克隆抗体在室温下于振荡器上孵育18小时;然后,它们被吸附到网格上。接下来,用PBS(10 mM Na2HPO4、1.76 mM KH2PO4(pH 7.4),137 mM NaCl和2.7
mM KCl)洗涤网格,并与与10–12 nm金纳米颗粒偶联的蛋白A于室温下在潮湿的房间孵育2小时。然后,用PBS洗涤网格以去除未结合的抗体,并用2%的磷钨酸溶液进行负染色10-15 s。在Jem1400电子显微镜中研究样品。
4.6 外泌体的流式细胞
经过两个阶段的超速离心和凝胶过滤后,将外泌体制剂与带有硫酸乙醛基团的乳胶球(Invitrogen,Waltham,MA,USA)一起在室温下孵育30分钟。加入TBS缓冲液(pH 7.5;(20 mM Tris-HCl,pH 7.5,0.15 M NaCl))至体积为200μL,并将混合物在搅拌下于4°C孵育过夜。接下来,将带有球的混合物与1 M甘氨酸(1:1)在22°C下孵育30分钟,以封闭未结合的乙二醛醛基团,以1600x g离心3分钟,并用200μL的水洗涤沉淀两次0.5%牛血清白蛋白在10%胎牛血清中。然后,将样品与结合有异花青素荧光标记的CD81抗体一起孵育,同时将与CD9的异硫氰酸荧光素荧光标记(Biolegend,圣地亚哥,加利福尼亚,美国)结合的抗体在4°C下孵育1 h,以1600×g离心。在22℃下3分钟,除去上清液,将沉淀重悬于200μLTBS中。在所有情况下,第一次超速离心后,最终混合物均对应于相同量的外泌体初始溶液。在没有囊泡的情况下与抗体一起孵育的乳胶球用作阴性对照。使用FACS Canto II流式细胞仪(BD Biosciences,美国加利福尼亚州圣何塞)分析获得的样品;结果使用FACSDiva版本6.1.3软件(BD
Biosciences,美国加利福尼亚州圣何塞)进行处理。
4.7 外泌体纳米颗粒的跟踪分析
凝胶过滤后,将胎盘囊泡制剂的等分试样重新悬浮在TBS缓冲液中。通过使用设备Nanosight NS300(英国Malvern)分析其运动轨迹(纳米颗粒跟踪分析),评估了各种大小的囊泡的相对大小和含量。 对于每种准备,均实施了3次连续且每次10 s的调查。数据分析使用Nanosight NTA v3.2(Malvern Instruments,Malvern,英国)。
4.8 SDS-PAGE化验
根据Laemmli的方法,使用含0.1%SDS的4-18%聚丙烯酰胺凝胶对外泌体蛋白质进行电泳分析[38]。在SDS-PAGE之前,将含有20–45μg蛋白质的外泌体制剂在含有50 mM Tris-HCl,pH 6.8、1%SDS,10%甘油,0.025%溴酚蓝,10
mM EDTA(有或没有10 mM)的缓冲液A中预孵育DTT在100℃下10-15分钟,然后涂到凝胶上。在某些情况下,在电泳前,将小泡在含有25 mM混合物的胰蛋白酶(10μM,Promega,Fitchburg,WI,USA)或胰凝乳蛋白酶(5μm,Sigma)的存在下于37°C孵育5分钟。 pH 7.5的Tris-HCl,0.33 mM DTT,0.03 mM EDTA,1.3 mM NaCl,2.5 mM MgCl2。通过添加缓冲液A终止反应,然后通过SDS-PAGE分离蛋白质。在25°C的缓冲液中进行电泳1.5–2小时:25 mM Tris-甘氨酸,pH
8.3,在100–170 V时使用0.1%SDS。蛋白质用考马斯R-250或胶体银染色。
4.9电泳后蛋白质的胰蛋白酶解
蛋白质鉴定使用1D或2D电泳后的胰蛋白酶水解产物的MALDI-TOF
MS和MS / MS光谱进行(如[38]中所述)。在2D电泳的情况下,首先使用等电聚焦蛋白质的装置(Protean IEF Cell,Bio-Rad,Hercules,CA,美国)进行蛋白质分离。为了根据蛋白质的等电点分离凝胶中的蛋白质,使用了条带(线性pH 3-10,18 cm,Bio-Rad,美国)。将外泌体保存在补液中(8 M尿素,2%NP-40、0.2%两性电解质(pH 3-10)和50
mM DTT)并转移到聚焦室中,将胶条放在凝胶和矿物上上油。将条带被动补水1 h,然后在50 V上主动补水12 h。在250 V下进行等电聚焦15分钟,然后在10,000 V下进行7
h。等电聚焦后,将条带在含0.38的缓冲液中孵育30分钟M Tris-HCl pH 8.8、6 M尿素,20%甘油,2%SDS和0.001%溴酚蓝。接下来,将试纸条在含有100 mM碘乙酰胺而无DTT的相同缓冲液中温育30分钟。孵育后,将胶条置于凝胶中并进行SDS电泳。蛋白用考马斯R-250染色。
SDS-PAGE化验后,将获得的凝胶用考马斯R-250染色,将其片段用100μLMilliQ水在振荡器上洗涤两次,每次15分钟,然后两次用50μL的含50%乙腈的50 mM NH4HCO3洗涤30分钟。为了除去H2O,将凝胶片段用100μL100%CH3CN洗涤20分钟。然后,使用真空蒸发器将这些凝胶碎片在30℃下干燥10分钟。为了水解蛋白质,将20μL的含12.5μg/ mL胰蛋白酶进行测序的25 mM NH4HCO3(Promega)添加到凝胶片中,并在0°C孵育45分钟后,除去溶液。接下来,将凝胶片段在37°C下于20μL的25 mM NH4HCO3中孵育18
h,然后除去溶液。为了提取肽,将凝胶片段在摇床上用25μL的含50%乙腈的50 mM NH4HCO3洗涤两次,每次15分钟。将经过3次凝胶处理的级分合并,冻干,溶解在10–20μL水中,用于MALDI-TOF质谱分析。
补充材料:以下材料均可在此网站获取http://www.mdpi.com/1422-0067/20/10/2434/s1.
贡献作者: E.E.B. and
S.E.S., different experiments; D.V.B. and P.S.D., MALDI mass spectrometry;
A.E.G. and E.I.R., electron microscopy; V.V.V. and G.A.N., work organization
and article writing.
赞助: This
research was maintained by the Russian Science Foundation 18-74-10055.
利益冲突: The author
has declared no competing interests.
缩写索引
Ab antibody
Abz
abzyme;
AI autoimmune
2D-electrophoresis Two-dimensional electrophoresis (isoelectrophocusing
and SDS-PAGE)
Evs extracellular
vesicles
MALDI-TOF matrix-assisted laser desorption/ionization
time-of-flight mass spectrometry
MBP myelin
basic protein
MM molecular
mass
MS multiple sclerosis
SDS-PAGE sodium
dodecyl sulphate–polyacrylamide gel electrophoresis
SLE systemic
lupus erythematosus
参考文献
1. Familari, M.; Gronqvist, T.; Masoumi,
Z.; Hansson, S.R. Placenta-derived extracellular vesicles: Their cargo and
possible functions. Reprod. Fertil. Dev. 2017, 29,
433–447. [CrossRef] [PubMed]
2. Dischof, P.; Klopper, A. Proteins of
the Placenta. Biochemistry, Biology, and Clinical Application; Karger:
Basel, Switzerland; Munchen, Germany; New York, NY, USA, 1984.
3. Garnica, A.D.; Chan, W.Y. The role of the
placenta in fetal nutrition and growth. J. Am. Coll. Nutr. 1996, 15,
206–222. [PubMed]
4. Alberts, B. The cell as a collection of
protein machines: Preparing the next generation of molecular biologists. Cell 1998, 92, 291–294. [CrossRef]
5. Lötvall, J.; Hill, A.F.; Hochberg, F.;
Buzás, E.I.; Di Vizio, D.; Gardiner, C.; Gho, Y.S.; Kurochkin, I.V.;
Mathivanan, S.; Quesenberry, P.; et al. Minimal experimental requirements for
definition of extracellular vesicles and their functions: A position statement
from the International Society for Extracellular Vesicles. J. Extracell.
Vesicles 2014, 3, 26913.
6. Nakayama, A. Proteomic analysis of
urinary exosomes. Rinsho Byori. 2014, 62, 684–691. [PubMed]
7. Raimondo, F.; Morosi, L.; Chinello, C.;
Magni, F.; Pitto, M. Advances in membranous vesicle and exosome proteomics
improving biological understanding and biomarker discovery. Proteomics 2011, 11, 709–720.
[CrossRef] [PubMed]
8. Vlassov, A.V.; Magdaleno, S.;
Setterquist, R.R.; Conrad, R. Exosomes: Current knowledge of their composition,
biological functions, and diagnostic and therapeutic potentials. Biochim.
Biophys. Acta 2012, 1820, 940–948.
[CrossRef] [PubMed]
9. Abramowicz, A.; Widlak, P.; Pietrowska,
M.A. Proteomic analysis of exosomal cargo: The challenge of high
purity vesicle isolation. Mol. Biosyst. 2016, 12,
1407–1419. [CrossRef] [PubMed]
10. Mincheva-Nilsson, L.; Baranov, V. The role of placental exosomes
in reproduction. Am. J. Reprod. Immunol.
2010, 63,
520–533. [CrossRef]
11. Mincheva-Nilsson, L. Placental exosome-mediated immune protection
of the fetus: Feeling groovy in a cloud
of
exosomes. Expert Rev. Obstet. Gynecol. 2010, 5, 619–634. [CrossRef]
12. Desrochers, L.M.; Antonyak, M.A.; Cerione, R.A. Extracellular
Vesicles: Satellites of Information Transfer in
Cancer and
Stem Cell Biology. Dev. Cell 2016, 37, 301–309. [CrossRef] [PubMed]
13. Choi, D.S.; Kim, D.K.; Kim, Y.K.; Gho, Y.S. Proteomics, transcriptomics
and lipidomics of exosomes and
ectosomes. Proteomics 2013, 13, 1554–1571. [CrossRef]
14. Admyre, C.; Johansson, S.M.; Qazi, K.R.; Filen, J.J.; Lahesmaa,
R.; Norman, M.; Neve, E.P.; Scheybius, A.;
Gabrielsson,
S. Exosomes with immune modulatory features are present in human breast milk. J.
Immunol.
2007, 179, 1969–1978. [CrossRef]
15. Liao, Y.; Alvarado, R.; Phinney, B.; Lönnerdal, B.Y. Proteomic
characterization of human milk whey proteins
during a
twelve-month lactation period. J. Proteome Res. 2011, 10,
1746–1754. [CrossRef]
16. Zonneveld, M.I.; Brisson,
A.R.; van Herwijnen, M.J.; Tan, S.; van de Lest, C.H.; Redegeld, F.A.; Garrsen,
J.; Wauben, M.H.; Nolte-t Hoen, E.N. Recovery of extracellular vesicles from
human breast milk is influenced by sample collection and vesicle isolation
procedures. J. Exracell. Vesicles 2014, 3, 24215. [CrossRef]
16. Lässer, C.; Alikhhani, V.S.; Erkström, K.; Eldh, M.; Paredes,
P.T.; Bossios, A.; Sjöstrand, M.; Gabrielsson, S.; Lötvall, J.; Valadi, H.C.
Human saliva, plasma and breast milk exosomes contain RNA: Uptake by
macrophages. J. Trasl. Med. 2011, 9, 9. [CrossRef]
17. Zhou, Q.; Li, M.; Wang, X.; Li, Q.; Wang, T.; Zhu, Q.; Zhou, X.;
Wang, X.; Gao, X.; Li, X. Immune-related microRNAs are abundant in breast milk
exosomes. Int. J. Biol. Sci. 2012, 8, 118–123. [CrossRef]
18. Torregrosa Paredes, P.; Gutzeit, C.; Johansson, S.; Admyre, C.;
Stenius, F.; Alm, J.; Scheynius, A.; Gabrielsson, S.P. Differences in exosome
populations in human breast milk in relation to allergic sensitization and
lifestyle. Allergy 2014, 69, 463–471. [CrossRef]
19. Munagala, R.; Aqil, F.; Jeybalan, J.; Gupta, R.C. Bovine
milk-derived exosomes for drug delivery. Cancer Lett. 2016, 371,
48–61. [CrossRef] [PubMed]
20. Yamada, T.; Inoshima, Y.; Matsuda, T.; Ishiguro, N.T. Comparison
of methods for isolating exosomes from bovine milk. J. Vet. Med. Sci. 2012, 74, 1523–1525. [CrossRef] [PubMed]
21. Gu, Y.; Li, M.; Wang, T.; Liang, Y.; Zhong,
Z.Y.; Gu, M.; Li, T.; Wang, Y.; Liang, Z.; Zhong, X.; et al. Lactation-related
microRNA expression profiles of porcine breast milk exosomes. PLoS ONE 2012, 7, e4369. [CrossRef]
22. Rout, E.D.; Webb, T.L.; Laurence, H.M.; Long, L.; Olver, C.S.
Transferrin receptor expression in serum exosomes as a marker of regenerative
anaemia in the horse. Equine Vet. J. 2015, 47, 101–106. [CrossRef]
23. Thery, C.; Amigorena, S.; Raposo, G.; Clayton, A.C. Current
Protocols in Cell Biology; Chambers, C., Ed.; John Wiley & Sons, Ltd.:
Somerset, NJ, USA, 2006; Chapter 3, Unit 3.22.
24. Ji, H.; Erfani, N.; Tauro, B.J.; Kapp, E.A.; Zhu, H.J.; Moritz,
R.L.; Lim, J.W.; Simpson, R.J. Difference gel electrophoresis analysis of
Ras-transformed fibroblast cell-derived exosomes. Electrophoresis 2008, 29, 2660–2671. [CrossRef] [PubMed]
25. Cvjetkovic, A.; Lötvall, J.; Lässer, C.J. The influence of rotor
type and centrifugation time on the yield and purity of extracellular vesicles. J. Extracell. Vesicles 2014, 3, 23111. [CrossRef]
26. Lamparski, H.G.; Metha-Damani, A.; Yao, J.Y.; Patel, S.; Hsu,
D.H.; Ruegg, C.; Le Pecq, J.B. Production and characterization of clinical
grade exosomes derived from dendritic cells. J. Immunol. Methods 2002, 270, 211–226. [CrossRef]
27. Brownlee, Z.; Lynn, K.D.; Thorpe, P.E.; Schroit, A.J. A novel
«salting-out» procedure for the isolation of tumor-derived exosomes. J.
Immunol. Methods 2014, 407, 120–126. [CrossRef]
28. Luo, S.S.; Ishibashi, O.; Ishikawa, G.; Ishikawa, T.; Katayama,
A.; Mishima, T.; Takizawa, T.; Shigihara, T.; Goto, T.; Izumi, A. Human Villous
Trophoblasts Express and Secrete Placenta-Specific MicroRNAs into Maternal
Circulation via Exosomes. Biol. Reprod. 2009, 81, 717–729.
[CrossRef]
29. Sarker, S.; Scholz-Romero, K.; Perez, A.; Illanes, S.; Mitchell,
M.; Rice, G.; Salomon, C. Placenta-derived exosomes continuously increase in
maternal circulation over the first trimester of pregnancy. J. Transl. Med. 2014, 12, 204. [CrossRef]
30. Tong, M.; Kleffmann, T.; Pradhan, S.; Johansson, C.L.; DeSousa,
J.; Stone, P.R.; James, J.L.; Chen, Q.; Chamley, L.W. Proteomic
characterization of macro-, micro- and nano-extracellular vesicles derived from
the same first trimester placenta: Relevance for feto-maternal communication. Hum.
Reprod. 2016, 31, 687–699. [CrossRef] [PubMed]
31. Baig, S.; Kothandaraman, N.; Manikandan, J.; Rong, L.; Ee, K.H.;
Ee, K.H.; Hill, J.; Lai, C.W.; Tan, W.Y.; Yeoh, F.; et al. Proteomic analysis
of human placental syncytiotrophoblast microvesicles in preeclampsia. Clin.
Proteomics 2014, 11, 40. [CrossRef]
32. Atay, S.; Gercel-Taylor, C.; Kesimer, M.; Taylor, D.D. Morphologic
and proteomic characterization of exosomes released by cultured extravillous
trophoblast cells. Exp. Cell Res. 2011, 317, 1192–1202. [CrossRef]
33. Morelli, A.E.; Larregina, A.T.; Shufesky, W.J.; Sullivan, M.L.;
Stolz, D.B.; Stolz, D.B.; Papworth, G.D.; Zahorchak, A.F.; Logar, A.J.; Wang,
Z.; et al. Endocytosis, intracellular sorting, and processing of exosomes by
dendritic cells. Blood 2004, 104, 3257–3266. [CrossRef]
34. Segura, E.; Nicco, C.; Lombard, B.; Véron, P.; Rapaso, G.;
Batteux, F.; Amigorena, S.; Théry, C. ICAM-1 on exosomes from mature dendritic
cells is critical for efficient naive T-cell priming. Blood 2005, 106, 216–223. [CrossRef]
36. Reinhardt, T.A.; Lippolis, J.D.; Nonnecke, B.J.; Sacco, R.E.
Bovine milk exosome proteome. J. Proteomics 2012, 75,
1486–1492. [CrossRef]
37. Soboleva, S.E.; Dmitrenok, P.S.; Verkhovod, T.D.; Buneva, V.N.;
Sedykh, S.E.; Nevinsky, G.A. Very stable high molecular mass multiprotein
complex with DNase and amylase activities in human milk. J. Mol. Recognit. 2015, 28, 20–34. [CrossRef]
38. Burkova, E.E.; Dmitrenok, P.S.; Sedykh, S.E.; Buneva, V.N.;
Soboleva, S.E.; Nevinsky, G.A. Extremely stable soluble high molecular mass
multi-protein complex with DNase activity in human placental tissue. PLoS
ONE 2014, 9, e111234. [CrossRef]
39. Sverdlov, E.D. Amedeo Avogadro’s cry: What is 1 μg of exosomes? Bioessays 2012, 34, 873–875. [CrossRef]
40. Sedykh, S.E.; Purvinish, L.V.; Monogarov, A.S.; Burkova, E.E.;
Grigor’eva, A.E.; Bulgakov, D.V.; Dmitrenok, P.S.; Vlassov, V.V.; Ryabchikova,
E.I.; Nevinsky, G.A. Purified horse milk exosomes contain an
unpredictable small number of major proteins. Biochim. Open 2017, 4, 61–72. [CrossRef]
41. Grigor’eva, A.E.; Dyrkheeva, N.S.; Bryzgunova, O.E.; Tamkovich,
S.N.; Chelobanov, B.P.; Ryabchikova, E.I.
Contamination
of exosome preparations, isolated from biological fluids. Biomed. Chem. 2017, 11, 265–271.
42. Vargas, A.; Zhou, S.; Ethier-Chiasson, M.; Flipo, D.; Lafond, J.;
Gilbert, C.; Barbeau, B. Syncytin proteins incorporated in placenta exosomes
are important for cell uptake and show variation in abundance in serum
exosomes from patients with preeclampsia. FASEB J. 2014, 28, 3703–3719. [CrossRef]
43. Jeppesen, D.K.; Fenix, A.M.; Franklin, J.L.; Higginbotham, J.N.;
Zhang, Q.; Zimmerman, L.J.; Liebler, D.C.; Ping, J.; Liu, Q.; Evans, R.; et al.
Reassessment of Exosome Composition. Cell 2019, 177,
428–445. [CrossRef]
[PubMed]
44. Maton, A.; Hopkins, J.; McLaughlin, C.W.; Johnson, S.; Warner,
M.Q.; LaHart, D.; Wright, J.D. Human Biology
and Health; Prentice
Hall: Englewood Cliffs, NJ, USA, 1993; ISBN 0-13-981176-1.
45. Gerke, V.; Creutz, C.E.; Moss, S.E. Annexins: Linking Ca2+ signalling
to membrane dynamics. Nat. Rev. Mol.
Cell Biol. 2005, 6, 449–461. [CrossRef]
46. Doherty, G.J.; McMahon, H.T. Mediation, modulation, and
consequences of membrane-cytoskeleton
interactions. Annu. Rev. Biophys. 2008, 37, 65–95. [CrossRef]
47. Štefková, K.; Procházková, J.; Pacherník, J. Alkaline phosphatase
in stem cells. Stem Cells Int. 2015,
2015, 628368.
[CrossRef]
48. Crichton, R.R.; Charloteaux-Wauters, M. Iron transport and
storage. Eur. J. Biochem. 1987, 164, 485–506.
[CrossRef] [PubMed]