我们的经验表明,研究人员使用的用于分离外泌体的方法仅允许获得某种程度上富集了外泌体的制剂。生物流体包含蛋白质的超分子聚集体,当离心和超速离心时,它们会与外泌体共沉淀。此外,我们最近发现,人乳和胎盘中含有非常稳定的高分子量(〜1000 kDa)多蛋白复合物,其大小可与外泌体相媲美[37,38]。另外,一些蛋白质可以特异性或非特异性地结合到包埋在其膜中的外泌体或受体的表面。考虑到所有这些因素,我们认为外泌体中所含蛋白质的文献报道数量可能被过度高估了。在这方面,E.D斯维尔德洛夫值得一提,他认为在外泌体的情况下,他们内部分子成分的定量评估被错误估计,对此他形象的表达为“肯定会使Amedeo Avogadro哭泣” [39]。
最近,我们对马奶的外泌体进行了蛋白质组学分析[40]。 通过几种常规离心和超速离心获得的外泌体制剂不仅包含外泌体(40–100 nm),而且还包含许多越来越小的囊泡,以及杂质蛋白及其寡聚复合物。 使用凝胶过滤从稳定的高分子复合物和其他蛋白质中进一步纯化外泌体后,根据牛奶样品的不同,在牛奶成分中仅检测到7-8种的主要蛋白质[40]。 在外泌体出现第一个波峰之后,我们在第二个峰中发现了先前在牛和人乳外泌体制剂中发现的所有其他蛋白质,但分子量较低[40]。
[41]的目的是引起研究人员对外泌体制剂被污染的关注。目前被广泛采纳的方案是通过顺序离心从各种生物流体中分离外泌体制剂。所有制剂(超过200种)均包含通过免疫电子显微镜鉴定的结合至CD63或CD9抗体的外泌体。除了外泌体,所有制剂均包含低电子密度污染结构,该结构没有内界膜,因此不是外泌体(“非囊泡”)。两种主要类型的“非囊泡”需要引起注意:大小为20–40 nm占大小为40–100 nm的外泌体所有结构的10–40%。 “非囊泡”的形态使得它们被分类为中密度脂蛋白和低密度脂蛋白(20–40 nm)以及极低密度脂蛋白(40–100 nm)。因此,未经额外纯化的外泌体制剂可能含有性质非常不同的杂质,包括蛋白质和核酸。在大多数已发表的文章中,都对此类粗制的外泌体制剂进行了精确的蛋白质和核酸含量分析。
在这项研究中,我们使用标准的离心方法分析了从四个人胎盘中获得的外泌体蛋白,并通过凝胶过滤对其进行了纯化。 凝胶过滤可以从外泌体制剂中分离出大量蛋白质,这些外泌体制剂在不同的离心过程中会与外泌体共沉淀。 使用一维和二维电泳分离纯化纯化的外泌体的蛋白质,并使用MALDI MS和MS / MS光谱法对它们的胰蛋白酶解产物进行鉴定,就像在马奶中一样[40]。 我们获得了意想不到的结果:从胎盘中分离出的外泌体仅包含10-12种主要蛋白质。
2. 结论
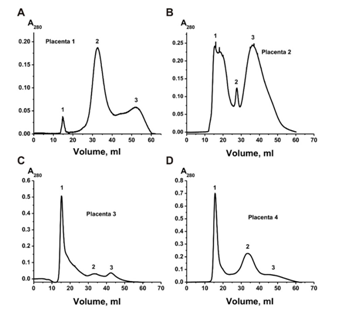
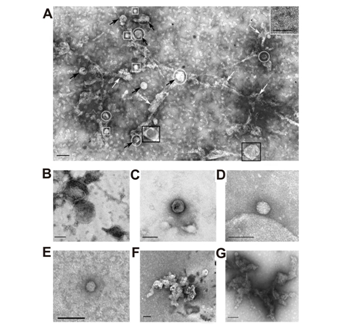
根据[14–28,34–36]进行离心和超速离心并进行一些更改[40],首先,我们从四个人类胎盘中获得了富含外泌体的制剂。 为了进一步纯化外泌体制剂,将获得的制剂通过过滤器(0.1–0.22μm),然后在分离出60–20,000 kDa蛋白质的Sepharose 4B上进行凝胶过滤。 图1显示了四种不同的凝胶过滤曲线-外泌体在第一个峰洗脱,与杂质蛋白的两个峰分离。 四种外泌体制剂显示出不同的吸收率(A280),分别对应于外泌体的第一个峰和在不同离心过程中与它们共沉淀的两个杂质蛋白峰。 图1. 四种胎盘粗制外泌体制剂的四种不同谱图(先前通过数种不同的离心方法部分纯化,并通过 0.1μm滤膜过滤)在Fusharose 4B色谱柱上通过FPLC凝胶过滤进行纯化:(-),在280 nm(A280) 的吸光度。 外泌体的四种不同制备方法(A-D)。 凝胶过滤后,可以看到三个峰(1-3)。 在每个阶段的分离后,都使用了透射电子显微镜对外泌体制剂进行了分析。过滤前,所有制剂均包含直径小于100 nm的囊泡(黑色箭头)和直径大于100 nm的囊泡(黑色正方形),微粒(白色正方形)和无定形蛋白质聚集体(白色箭头)(图2A) 。图2还显示了富含外泌体的制剂的几种单独的特定结构:尺寸大于100 nm的大膜结构(B);直径小于100 nm的囊泡(C),尺寸不超过40 nm的无限制膜的微粒(直径为40–60 nm的种群II的微粒)(G)和尺寸小于40 nm(种群I的直径为20–40 nm的微粒)(D);聚集蛋白簇(E和G);铁蛋白环结构(10-14 nm)(插图A)。 通过凝胶过滤后,制剂包含各种大小的外泌体(30–100 nm),以及一些环状超分子形式(10–14 nm),但不含可见的无定形蛋白质物质(图3A,B)。通常,外泌体必须包含CD81和/或CD63 [5]。我们使用直接方法;通过凝胶过滤纯化的囊泡含有CD81和CD63。这些标记蛋白用针对CD81(图3C,D)和CD63(图3E–G)的抗体标记。因此,就其表面上四跨膜蛋白CD81和CD63的形态,大小和含量而言,纯化的胎盘囊泡符合典型外泌体的要求。 在第一次,第二次超速离心和凝胶过滤后,使用流式细胞仪评估含有CD9和CD81的囊泡的相对量(图4)。凝胶过滤后的胎盘囊泡包含78.4±4.0%的CD9囊泡和74.4±4.0%的CD81颗粒(图4E,F)。凝胶过滤后的颗粒产率较高,约为90%–93%。因此,显而易见的是,凝胶过滤不会导致外泌体主要部分的损失。凝胶过滤后,不同大小的囊泡含量使用纳氏磁道分析法进行了评估(图5A)。通过纳米径分析发现的估计颗粒的流体动力学尺寸的囊泡的平均大小(并且无法区分单个颗粒及其缔合体)明显高于电子显微镜的情况。然而,囊泡主要部分的平均大小(84±5 nm; 86%±3%)与电子显微镜数据非常一致,有关电子制剂中主要存在40至100 nm大小的颗粒。